受理號:CQZ2100988
醫(yī)療器械產(chǎn)品注冊技術審評報告
產(chǎn)品中文名稱:膝關節(jié)置換手術導航定位系統(tǒng)?
產(chǎn)品管理類別:第三類?
申請人名稱:蘇州微創(chuàng)暢行機器人有限公司
國家藥品監(jiān)督管理局?
醫(yī)療器械技術審評中心
基本信息?
一�、申請人名稱?蘇州微創(chuàng)暢行機器人有限公司?
二��、申請人住所 蘇州工業(yè)園區(qū)鳳里街 151 號 3 號廠房部分區(qū)域?
三�����、生產(chǎn)地址 蘇州工業(yè)園區(qū)鳳里街 151 號 3 號廠房 3 層 A 區(qū)
技術審評概述?
該產(chǎn)品由導航控制臺(導航臺車、光學導航設備��、顯示器)�����、 手術平臺(機械臂、手術臺車)���、手術輔助工具��、光學定位標記��、 腳踏開關和線纜組成��。?
(二)產(chǎn)品適用范圍 該產(chǎn)品與經(jīng)驗證的膝關節(jié)假體聯(lián)合使用�����,在成人全膝關節(jié) 置換手術中�����,用于膝關節(jié)假體和手術工具的導航定位�����。?
(四)工作原理 該產(chǎn)品工作原理為術前規(guī)劃及術中定位�。即術者在術前基 于患者情況及術前 CT 圖像完成術前規(guī)劃�����。術中基于光學導航系 統(tǒng)反饋的實時臨床參數(shù)完成術中評估并調整術前規(guī)劃,隨后機 械臂在光學導航系統(tǒng)輔助下完成截骨面定位����,術者通過機械臂 輔助完成截骨。?
該產(chǎn)品性能指標包括物理性能�����、軟件功能(導航軟件���、控 制軟件、使用限制)�、操作性能(系統(tǒng)定位精度(位置重復性、 姿態(tài)重復性和距離準確性)�����、系統(tǒng)精度(位置準確度和姿態(tài)準確 度)����、機械臂各軸運動范圍、機械臂末端啟動力����、工作空間范圍��、 靶標跟蹤響應時間�、故障響應時間��、臺車移動力�、臺車鎖緊力、 機械臂保持力����、機械臂滿載的偏移量、機械臂抱閘鎖緊力����、噪 聲、刷新率����、最大追蹤數(shù)量)、網(wǎng)絡安全��、光學定位標記��、手術 輔助工具�、報警要求��、腳踏性能�����、電氣安全�����、電磁兼容性等�����。?
申請人針對上述性能指標提交了產(chǎn)品性能研究資料,同時 提交了產(chǎn)品技術要求與檢測報告�,檢測結果與產(chǎn)品技術要求相符。?
該產(chǎn)品所含手術輔助工具中截骨板�����、部分靶標支架頭端�����、 固定針固定組件��、靶標固定螺桿、靶標固定轉體����、擰緊把手、 固定針安裝導向器�、固定針、骨定位針��、滑車平面定位片��、旋 擰壓緊柱與人體骨/組織短期接觸�����;光學定位標記存在脫落風險�����, 按照與骨/組織短期接觸進行評價����。?
申請人根據(jù) GB/T 16886.1-2011《醫(yī)療器械生物學評價 第 1 部分:風險管理過程中的評價與試驗》進行了生物相容性評價�, 證明產(chǎn)品生物相容性風險可接受。
光學定位標記以無菌狀態(tài)提供��,采用輻照滅菌����。申請人提 交了滅菌過程確認報告���,證實產(chǎn)品無菌保證水平(SAL)滿足 要求��。?
手術輔助工具使用前由終端用戶進行滅菌�����。申請人提交了 滅菌研究資料���,符合要求。?
申請人提供了光學定位標記的有效期研究資料����,通過加速 老化試驗確定產(chǎn)品有效期���,其貨架有效期為 0.5 年���。?
依據(jù)《有源醫(yī)療器械使用期限指導原則》提交了產(chǎn)品穩(wěn)定 性研究資料。通過老化測試和關鍵部件的壽命測試分析等方法 確認了產(chǎn)品的使用期限�,該產(chǎn)品使用期限為 7 年����。?
申請人提供了光學定位標記無菌初包裝的確認資料�����,并提 交了產(chǎn)品運輸包裝驗證報告�,證實包裝完整性符合設計要求。?
該產(chǎn)品軟件包括運動控制軟件�、電源板嵌入式軟件、手術 導航軟件���,軟件安全級別均為 C 級�,發(fā)布版本均為 1��,運動控 制軟件完整版本為 1.3.0.1�,電源板嵌入式軟件完整版本為 1.1.1.1,手術導航軟件完整版本為 1.3.0.10���;申請人按照《醫(yī)療 器械軟件注冊技術審查指導原則》提交了相應級別的軟件描述文檔和軟件版本命名規(guī)則真實性聲明�����,證實該產(chǎn)品軟件設計開 發(fā)過程規(guī)范可控����,綜合剩余風險均可接受。?
申請人根據(jù)《醫(yī)療器械網(wǎng)絡安全注冊技術審查指導原則》 要求��,提交了網(wǎng)絡安全描述文檔����,證明該產(chǎn)品現(xiàn)有網(wǎng)絡安全風 險可控,已建立網(wǎng)絡安全應急響應預案�����。?
GB 9706.1-2007 《醫(yī)用電氣設備 第 1 部分:安全通用要求》?
GB 9706.15-2008《醫(yī)用電氣設備 第 1-1 部分:安全通用要 求 并列標準:醫(yī)用電氣系統(tǒng)安全要求》?
YY 0505-2012 《醫(yī)用電氣設備 第 1-2 部分:安全通用要 求并列標準:電磁兼容要求和試驗》?
YY 0709-2009 《醫(yī)用電氣設備 第 1-8 部分:安全通用要 求 并列標準:通用要求��,醫(yī)用電氣設備和醫(yī)用電氣系統(tǒng)中報警 系統(tǒng)的測試和指南》?
YY 1057-2016 《醫(yī)用腳踏開關通用技術條件》 申請人提交了相應檢測報告�����,證實該產(chǎn)品符合上述標準要 求���。?
申請人通過臨床試驗路徑開展臨床評價���。該項研究采用前 瞻性���、多中心����、單組目標值設計�����,在五家醫(yī)療機構開展臨床試驗�����。?
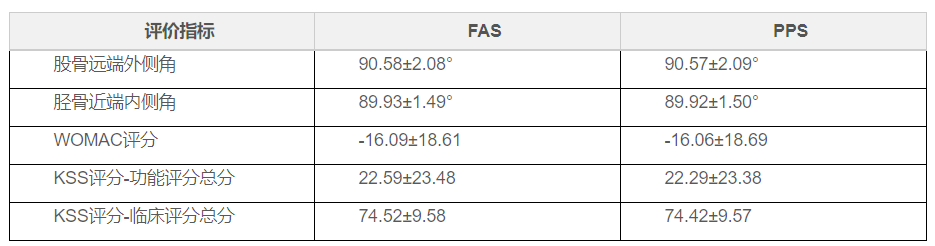
該項研究入組 106 例���,以臨床成功率(即術后出院前下肢 力線與預期規(guī)劃偏移的角度≤ 3°臨床成功的例數(shù)占完成手術例 數(shù)的百分比)為主要評價指標��;股骨遠端外側角���、脛骨近端內 側角、KSS 評分(治療后與基線差值)��、WOMAC 評分(治療后 與基線差值)為次要評價指標�����;研究期間發(fā)生的所有不良事件 及術后植入關節(jié)假體的位置情況作為安全性評價指標。?
主要評價指標����,F(xiàn)AS 集 106 例,臨床成功 105(99.06%)例����;PPS 集 105 例,臨床成功 104(99.05%)例�。FAS 集與 PPS 集中, 臨床成功率的 95%可信區(qū)間分別為[94.86%�����,99.98%][94.81%�����, 99.98%]����。下限均大于目標值 89%,臨床試驗結論成立�����。?
安全性評價指標:SS 集 106 例受試者�����,不良事件發(fā)生率 50.94%�,嚴重不良事件發(fā)生率 3.77%,均判定與申報產(chǎn)品無關��。臨床試驗中未發(fā)生器械缺陷���。?
該產(chǎn)品主要受益為:與經(jīng)驗證的膝關節(jié)假體聯(lián)合使用����,在 成人全膝關節(jié)置換手術中,用于膝關節(jié)假體和手術工具的導航 定位����,并可降低患者和醫(yī)師的 X 射線輻射風險。?
1.光學定位系統(tǒng)受到遮擋無法定位的風險�����,通過軟件提示、 用戶培訓進行風險控制���。?
2.機械臂非預期運動的風險��,通過優(yōu)化設計進行風險控制���。
3.一次性使用器械未按要求一次性使用,重復性使用器械滅 菌不徹底�����,未按照說明書進行清潔消毒等����,造成交叉感染,通 過用戶培訓進行風險控制���。?
4.用戶操作不規(guī)范導致的風險���,通過用戶培訓進行風險控 制。上述風險均在說明書中予以提示��。
任何具有不適宜采用傳統(tǒng)膝關節(jié)置換手術的相對或絕對禁 忌癥患者��,同樣不適用于采用膝關節(jié)置換手術導航定位系統(tǒng)輔 助膝關節(jié)置換手術。?
微創(chuàng)膝關節(jié)置換手術導航定位系統(tǒng)的患者選擇應該基于手 術醫(yī)師對患者具體情況的判斷�,在準備行導航輔助 TKA 前,手 術醫(yī)師應考慮下述情況:?
1.髖關節(jié)連接的完整性是完成骨注冊的必要條件�;?
2.手術區(qū)域附近的金屬物品會影響 CT 掃描的質量�,進而影 響手術規(guī)劃的精度;?
4.嚴重骨質疏松的患者會影響假體穩(wěn)定性�;?
5.患者體型會影響手術復雜性,術前應評估患者 BMI��;?
6.韌帶結構缺失或不穩(wěn)可能會影響術后關節(jié)穩(wěn)定性���;
7.顯著的畸形(如屈曲攣縮�����、固定膝內外翻等)對手術的影響應被仔細評估����;?
8.無法使用指定全膝關節(jié)置換系統(tǒng)進行手術的患者不能使 用本系統(tǒng)進行手術���;?
9.其他醫(yī)生認為可能影響手術正常進行的因素�����。?
綜上��,根據(jù)申請人提供的申報資料����,經(jīng)綜合評價,在目前 認知水平上�����,產(chǎn)品臨床受益大于風險����。
綜合評價意見?
注冊申請人申請境內第三類醫(yī)療器械注冊,該申請項目適 用于創(chuàng)新醫(yī)療器械特別審查程序(受理號:CQTS2000027)�, 提供的產(chǎn)品注冊申請資料齊全。依據(jù)《醫(yī)療器械監(jiān)督管理條例》(國務院令第 680 號)��、 《醫(yī)療器械注冊管理辦法》(國家食品藥品監(jiān)督管理總局令 2014 年第 4 號)等相關醫(yī)療器械法規(guī)和配套規(guī)章�,經(jīng)系統(tǒng)評 價注冊申請資料后,在目前認知水平上�,該產(chǎn)品上市帶來的受 益大于風險,符合現(xiàn)行的技術審評要求�����,建議予以注冊。?
2022 年 4 月 18 日