受理號(hào):JQZ2100350?
醫(yī)療器械產(chǎn)品注冊(cè)技術(shù)審評(píng)報(bào)告?
產(chǎn)品中文名稱:藥物洗脫冠脈支架系統(tǒng)?
產(chǎn)品英文(原文)名稱:Resolute Onyx Zotarolimus-Eluting Coronary Stent System
申 請(qǐng) 人 名 稱 :Medtronic, Inc.美敦力公司?
國(guó)家藥品監(jiān)督管理局?
醫(yī)療器械技術(shù)審評(píng)中心
基本信息?
一��、申請(qǐng)人名稱 Medtronic, Inc.美敦力公司?
二��、申請(qǐng)人住所 710 Medtronic Parkway Minneapolis Minnesota 55432 USA?
三�����、生產(chǎn)地址 Parkmore Business Park West Galway Ireland
技術(shù)審評(píng)概述
(一)產(chǎn)品結(jié)構(gòu)及組成?
該產(chǎn)品由藥物洗脫支架和快速交換型輸送系統(tǒng)組成�。藥物 洗脫支架由金屬支架�����、底涂層和藥物涂層組成;金屬支架由 MP35N 鈷鎳鉻鉬合金外殼和 Pt10Ir 鉑銥合金芯絲制成�;底涂層 由Parylene C組成;藥物涂層由佐他莫司(Zotarolimus)和BioLinx 聚合物(C10/C19/PVP)構(gòu)成�����,藥物含量的標(biāo)稱劑量 1.6μg/mm2�。環(huán)氧乙烷滅菌,一次性使用���。貨架有效期 3 年�。?
該產(chǎn)品適用于符合進(jìn)行經(jīng)皮腔內(nèi)冠狀動(dòng)脈成形術(shù)(PTCA)���, 參考血管直徑為 2.0mm 至 5.0mm�,病變長(zhǎng)度≤38mm 的患者擴(kuò) 大原發(fā)性冠狀動(dòng)脈狹窄的血管直徑�����。?
表 1 產(chǎn)品型號(hào)規(guī)格列表
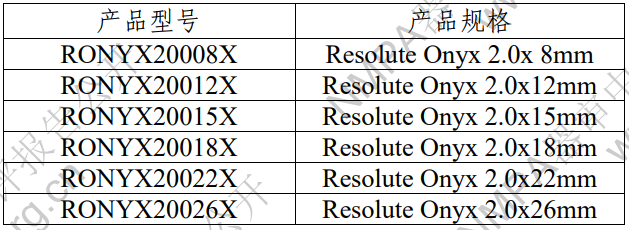
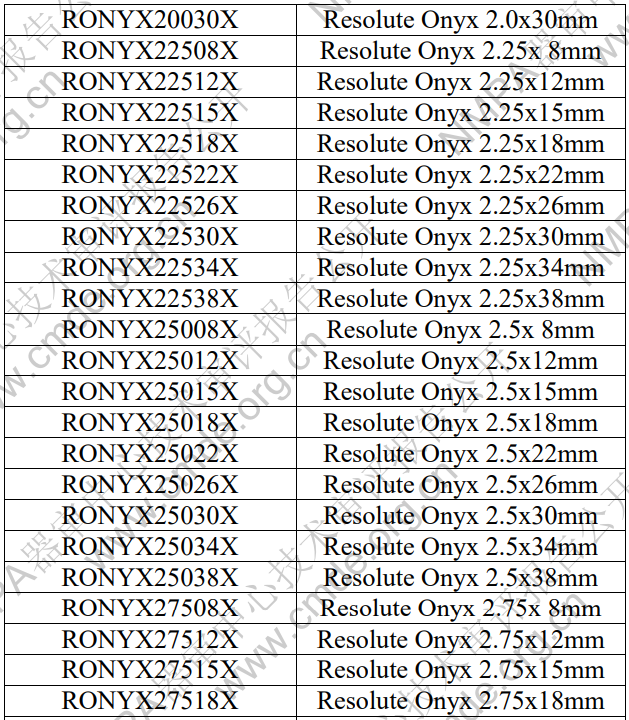


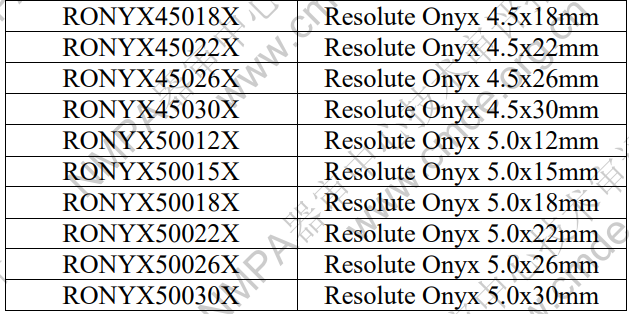
型號(hào)/規(guī)格劃分說(shuō)明:舉例 RONYX40018X RONYX:代表產(chǎn)品的名稱 Resolute Onyx 400 代表支架的標(biāo)稱直徑為 4.00 mm 18 代表支架的標(biāo)稱長(zhǎng)度為 18mm
Resolute Onyx 支架預(yù)裝在輸送導(dǎo)管的球囊部分��,并使用輸 送導(dǎo)管植入冠狀動(dòng)脈病變部位�����。輸送導(dǎo)管球囊用于擴(kuò)張并植入 支架。支架表面有 BioLinx 聚合物和佐他莫司涂層�,預(yù)期有助 于減少支架內(nèi)再狹窄的發(fā)生率。該支架預(yù)期用作永久性植入器 械����。?
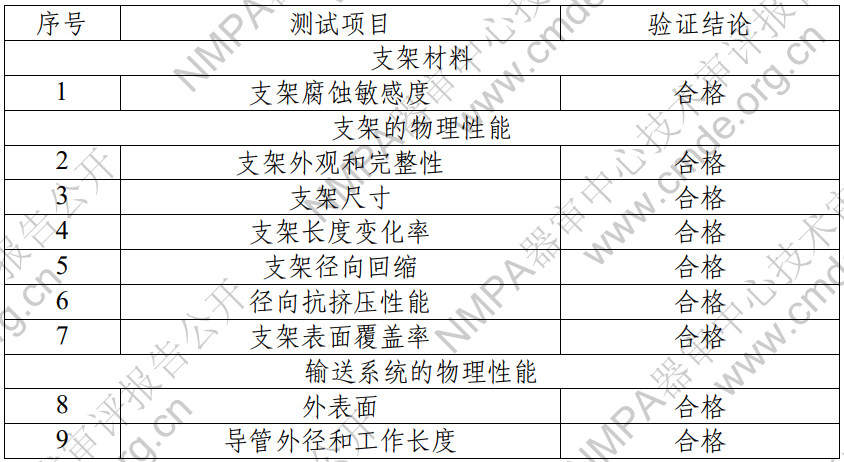
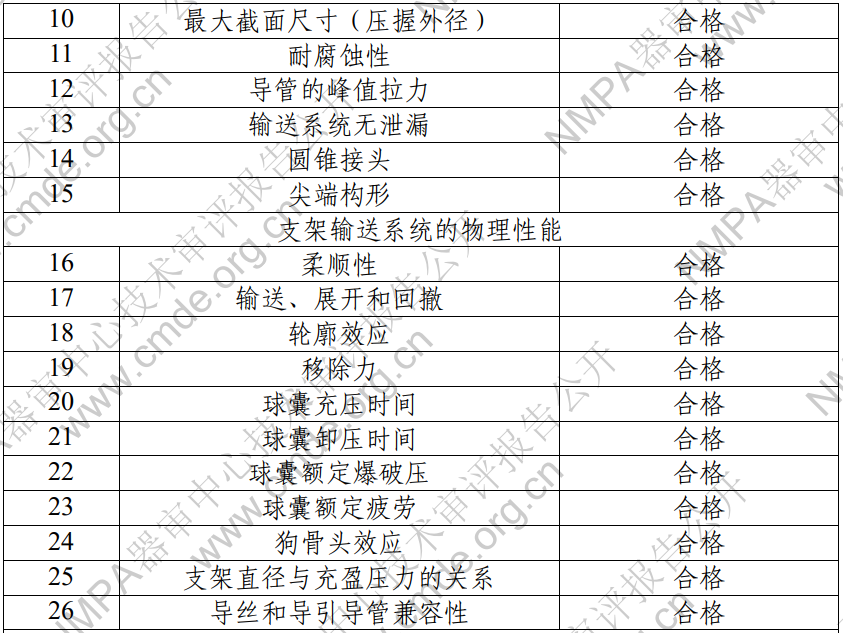
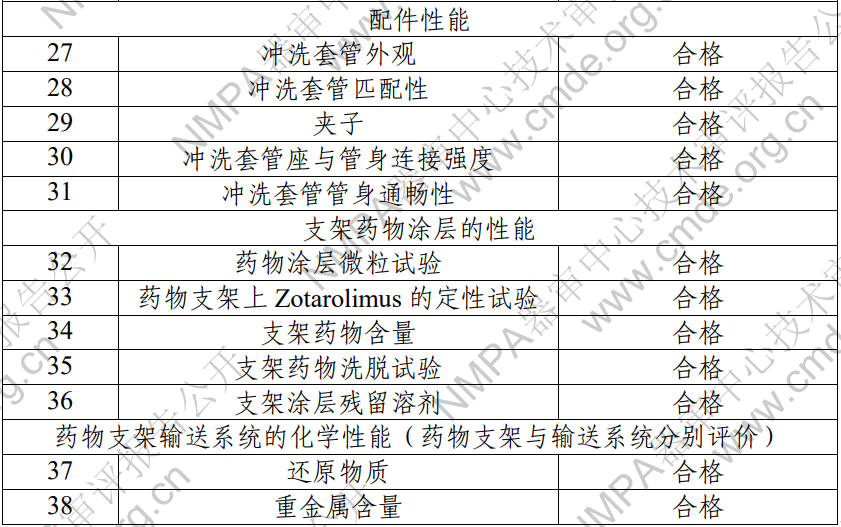
1. 產(chǎn)品技術(shù)要求研究 產(chǎn)品技術(shù)要求研究項(xiàng)目如表 2 所示。?
表 2 產(chǎn)品技術(shù)要求研究摘要

2. 產(chǎn)品性能評(píng)價(jià)?
針對(duì)產(chǎn)品各部件性能開(kāi)展驗(yàn)證�,項(xiàng)目包括:支架外徑、導(dǎo) 管有效長(zhǎng)度和尺寸�、支架內(nèi)徑和支架內(nèi)徑增量、支架展開(kāi)長(zhǎng)度 (含標(biāo)稱壓力下的縮短幅度等)�、支架至標(biāo)記帶間隙和球囊伸 出、順應(yīng)性��、支柱厚度�、抗扭結(jié)性、病變通過(guò)性和導(dǎo)引導(dǎo)管回 撤���、支架完整性���、徑向疲勞和耐腐蝕、有限元分析、球囊額定 爆破壓����、縱向支架變形扭曲力、泄壓時(shí)間�、抗拉強(qiáng)度、MRI 兼 容性����、支架回縮、支架徑向支撐力����、輪廓/直徑、載藥量和均勻 性����、浸沒(méi)和展開(kāi)、支架固位��、輸送展開(kāi)及回撤��、遠(yuǎn)軸標(biāo)記距離 和交換接頭距離��、支架表面積比�����、材料成分、點(diǎn)蝕和縫隙腐蝕 電位����、短期涂層完整性、長(zhǎng)期涂層耐久性�����、導(dǎo)管腐蝕����、狗骨頭���、 輪廓效應(yīng)����、球囊疲勞�、同時(shí)輸送雙導(dǎo)管的導(dǎo)引導(dǎo)管兼容性、電 偶腐蝕����、支架徑向強(qiáng)度����、沖洗套管外觀����、沖洗套管管腔暢通性、 沖洗套管兼容性�、沖洗套管管座與管身連接強(qiáng)度。結(jié)果表明產(chǎn)品符合設(shè)計(jì)輸入要求��。
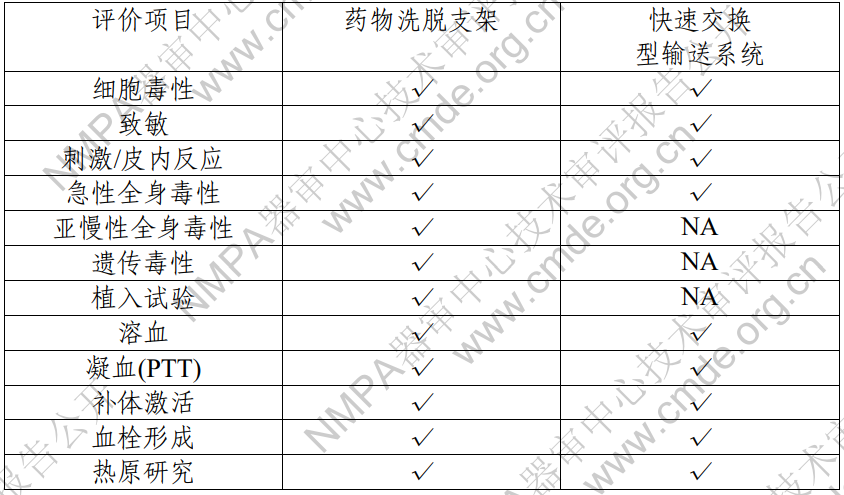
藥物洗脫冠脈支架系統(tǒng)包含藥物洗脫支架和快速交換型輸 送系統(tǒng)兩部分��,其中藥物洗脫支架為植入器械�����,與循環(huán)血液長(zhǎng) 期接觸��;輸送系統(tǒng)為外部接入器械����,與循環(huán)血液短期接觸。申 請(qǐng)人按照GB/T 16886系列標(biāo)準(zhǔn)內(nèi)容對(duì)植入器械及外部接入器械 分別進(jìn)行了生物相容性評(píng)價(jià)��,產(chǎn)品的生物相容性風(fēng)險(xiǎn)可接受��, 具體評(píng)價(jià)項(xiàng)目詳見(jiàn)表 3。?
表 3 生物相容性評(píng)價(jià)項(xiàng)目表
該產(chǎn)品采用環(huán)氧乙烷滅菌�����,無(wú)菌狀態(tài)提供��。申請(qǐng)人提供了 滅菌確認(rèn)報(bào)告��,證明無(wú)菌保證水平為 10-6����。
該產(chǎn)品貨架有效期為 3 年。申請(qǐng)人提供了貨架有效期驗(yàn)證 報(bào)告�,包括產(chǎn)品穩(wěn)定性����、包裝完整性和運(yùn)輸模擬驗(yàn)證資料。?
申請(qǐng)人在豬動(dòng)物模型上對(duì)該器械進(jìn)行了動(dòng)物研究以驗(yàn)證產(chǎn) 品使用性能及安全性�����,包括 5 天安全性研究�、28 天安全性評(píng)價(jià)、 90 天安全性評(píng)價(jià)���。設(shè)立對(duì)照組��,并開(kāi)展了相關(guān)動(dòng)物研究����。主要 終點(diǎn)包括急性可輸送性、血管造影表現(xiàn)�、形態(tài)分析、組織病理 學(xué)以及 SEM 分析�。?
開(kāi)展了體內(nèi)藥物釋放和體內(nèi)藥代動(dòng)力學(xué)相關(guān)研究,研究時(shí) 間點(diǎn) 1/2/3/7/14/28/60/90/180 天�,測(cè)定了實(shí)驗(yàn)動(dòng)物重要組織和臟 器(如支架局部組織、遠(yuǎn)端心肌組織����、腎臟、肝臟���、肺臟)中 藥物的含量����。動(dòng)物試驗(yàn)結(jié)果表明���,產(chǎn)品達(dá)到預(yù)期設(shè)計(jì)要求�����。
三�����、臨床評(píng)價(jià)概述?
該產(chǎn)品采用臨床試驗(yàn)路徑進(jìn)行臨床評(píng)價(jià)�。申請(qǐng)人提交多個(gè) 臨床試驗(yàn)數(shù)據(jù)。?
臨床試驗(yàn)?zāi)康氖且酝瑥S家已上市銷售的同類產(chǎn)品(Resolute Integrity��,國(guó)械注進(jìn) 20163130682)為對(duì)照��,評(píng)價(jià)申報(bào)產(chǎn)品用于擴(kuò)大原發(fā)性冠狀動(dòng)脈狹窄直徑的臨床有效性和安全性����。臨床試 驗(yàn)采用隨機(jī)、平行對(duì)照�、非劣效臨床設(shè)計(jì)�����。?
1. 試驗(yàn)方案 該試驗(yàn)在 17 家臨床機(jī)構(gòu)開(kāi)展�����,計(jì)劃入組 585 例患者,實(shí)際 完成入組患者 537 例(試驗(yàn)組 262 例/對(duì)照組 275 例)��。主要評(píng)價(jià) 指標(biāo)為定量冠脈血管造影(QCA)測(cè)量的術(shù)后 9 個(gè)月支架內(nèi)晚 期管腔丟失(LLL)�����。次要評(píng)價(jià)指標(biāo)為即刻成功 (器械成功���、 病變成功���、手術(shù)成功)。?
以下次要臨床終點(diǎn)在術(shù)后 30 天����、6 個(gè)月、9 個(gè)月及 12 個(gè)月 進(jìn)行評(píng)價(jià):主要心臟不良事件(MACE)����,定義為由死亡、心肌 梗死(Q 波或非 Q 波)�����,或通過(guò)介入方法或手術(shù)方法進(jìn)行的臨床 驅(qū)動(dòng)的靶病變血運(yùn)重建所構(gòu)成的復(fù)合終點(diǎn);死亡(心源性及非 心源性死亡)����;心肌梗死(所有的心肌梗死及靶血管心肌梗死 (TVMI));所有的血運(yùn)重建(包括靶病變血運(yùn)重建(TLR)�����、 靶血管血運(yùn)重建(TVR)及非靶血管血運(yùn)重建(Non-TVR))�����;靶血管失?�。═VF)�,定義為由心源性死亡、靶血管心肌梗死或 臨床驅(qū)動(dòng)的靶血管血運(yùn)重建(TVR)構(gòu)成的復(fù)合終點(diǎn)��;靶病變 失敗 (TLF)��,定義為由心源性死亡�����、靶血管心肌梗死或臨床驅(qū) 動(dòng)的靶病變血運(yùn)重建(TLR)構(gòu)成的復(fù)合終點(diǎn)�;支架血栓(ST) (采用 ARC 定義)。非劣效界值選取 0.16mm��。
(1)主要評(píng)價(jià)指標(biāo)?
主要終點(diǎn)分析(按病變):QCA FAS 集中�����,試驗(yàn)組的 9 個(gè) 月支架內(nèi)晚期管腔丟失(LLL)均值(±標(biāo)準(zhǔn)差)為 0.21(± 0.39)mm�����,對(duì)照組的 9 個(gè)月支架內(nèi)晚期管腔丟失(LLL)均值 ( ± 標(biāo) 準(zhǔn) 差 ) 為 0.17 ( ± 0.40 ) mm �����。?
95% 置 信 區(qū) 間 為 [-0.04,0.09]mm (p<0.0001)���;QCA PP 集中�����,試驗(yàn)組的主要終 點(diǎn)為 0.20± 0.39mm�����,對(duì)照組的主要終點(diǎn)為 0.17±0.40mm���,95% 置信區(qū)間為[-0.04, 0.08]mm(p 值<0.0001)����。?
主要終點(diǎn)分析(按受試者):QCA FAS 集中���,試驗(yàn)組的 9 個(gè)月支架內(nèi)晚期管腔丟失(LLL)均值(±標(biāo)準(zhǔn)差)為 0.21(± 0.38) mm���,對(duì)照組的 9 個(gè)月支架內(nèi)晚期管腔丟失(LLL)均值 (±標(biāo)準(zhǔn)差)為 0.20(±0.41)mm;95%置信區(qū)間為[-0.07�����,0.08] (p<0.0001��,基于非劣效界值 0.16mm)�。QCA PP 集中,試驗(yàn)組 的主要終點(diǎn)為 0.20(±0.39)mm���,對(duì)照組的主要終點(diǎn)為 0.20(± 0.41)mm�����;95%置信區(qū)間為[-0.07��,0.07]mm(p<0.0001)����。(2)次要評(píng)價(jià)指標(biāo) 即刻成功:試驗(yàn)組和對(duì)照組的病變成功率�����、器械成功率�、 手術(shù)成功率和器械特定的手術(shù)成功率分別為 94.0%和 92.7%;93.1%和 92.7%�;90.4%和 91.2%;及 89.7%和 91.2%���。
在 12 個(gè)月時(shí)���,分別評(píng)價(jià)試驗(yàn)組 vs.對(duì)照組的臨床終點(diǎn),結(jié) 果如下:?
靶病變失敗 (TLF)(心源性死亡���、靶血管心肌梗死或臨床 驅(qū)動(dòng)的 TLR):6.9%(18/259)vs. 4.7%(13/274)�,p=0.367���。主要心臟不良事件(MACE)(死亡���、心肌梗死(Q 波或非 Q 波)��,或經(jīng)介入或手術(shù)方法進(jìn)行的臨床驅(qū)動(dòng)的靶病變血運(yùn)重 建:7.3%(19/259)vs. 5.1%(14/274)���,p=0.376。全因死亡(心源性����、非心源性):心源性死亡:0.0% (0/259) vs. 0.0%(0/274),p=NA�;非心源性死亡:0.0%(0/259)vs. 0.4% (1/274),p=1.000���。心肌梗死:所有心肌梗死:3.9%(10/259)vs. 1.1%(3/274)����, p=0.074�����;靶血管心肌梗死(TVMI):3.5%(9/259)vs. 1.1% (3/274)��,p=0.119�����;Q 波:0.8%(2/259)vs. 0.4%(1/274),p=0.614�����;非 Q 波:3.1%(8/259)vs. 0.7%(2/274)���,p=0.057。臨床驅(qū)動(dòng)的血運(yùn)重建:靶病變血運(yùn)重建(TLR):5.0% (13/259)vs. 4.0%(11/274)���,p=0.726�����;靶血管血運(yùn)重建(TVR):6.6%(17/259)vs. 4.4%(12/274)��,p=0.358����;非靶血管血運(yùn)重 建(Non-TVR):2.3%(6/259)vs. 0.4%(1/274)��,p=0.062�����。靶血管失敗(TVF)(心源性死亡���、靶血管心肌梗死或臨床 驅(qū)動(dòng)的 TVR):8.1%(21/259)vs. 5.1%(14/274)���,p=0.222。
支架血栓(根據(jù) ARC 定義):明確的/很可能的支架血栓:0.8%(2/259)vs. 0.4%(1/274)�����,p=0.614�;明確的支架血栓:0.8%(2/259)vs. 0.4%(1/274),p=0.614�;很可能的支架血栓:0.0%(0/259)vs. 0.0%(0/274),p=NA����;可能的支架血栓:0.0% (0/259)vs. 0.0%(0/274),p=NA�。3. 安全性評(píng)價(jià)指標(biāo) 試驗(yàn)組與對(duì)照組嚴(yán)重不良事件發(fā)生率為 26.0% vs. 27.3%, 器械缺陷試驗(yàn)組與對(duì)照組各發(fā)生兩起����,兩組間無(wú)統(tǒng)計(jì)學(xué)差異��。?
該試驗(yàn)在 18 家臨床機(jī)構(gòu)開(kāi)展����,入組患者 853 例�。主要評(píng)價(jià) 指標(biāo)為術(shù)后 12 個(gè)月時(shí)的靶病變失敗(TLF)��。次要評(píng)價(jià)為即刻成 功(器械成功���、病變成功、手術(shù)成功)�����;以下次要臨床終點(diǎn)在術(shù) 后 30 天����、6 個(gè)月、9 個(gè)月及 12 個(gè)月進(jìn)行評(píng)價(jià):主要心臟不良事 件(MACE)���,定義為由死亡�����、心肌梗死(Q 波或非 Q 波)�,或 通過(guò)介入方法或手術(shù)方法進(jìn)行的臨床驅(qū)動(dòng)的靶病變血運(yùn)重建所 構(gòu)成的復(fù)合終點(diǎn);死亡(心源性及非心源性死亡)��;心肌梗死(所 有的心肌梗死及靶血管心肌梗死(TVMI))����;所有的血運(yùn)重建(包 括靶病變血運(yùn)重建(TLR)、靶血管血運(yùn)重建(TVR)及非靶血 管血運(yùn)重建(Non-TVR))����;靶血管失敗(TVF)�,定義為由心源性死亡、靶血管心肌梗死或臨床驅(qū)動(dòng)的靶血管血運(yùn)重建(TVR) 構(gòu)成的復(fù)合終點(diǎn)���;靶病變失?����。═LF)����,定義為由心源性死亡、 靶血管心肌梗死或臨床驅(qū)動(dòng)的靶病變血運(yùn)重建(TLR)構(gòu)成的 復(fù)合終點(diǎn)����;支架血栓(ST)(采用 ARC 定義)。目標(biāo)值選取 11.9%�。?
(1)主要評(píng)價(jià)指標(biāo)?
FAS 集中,靶病變失敗的發(fā)生率為 5.5%[4.2%����,7.3%],顯 著低于 11.9%的性能目標(biāo)值(p<0.0001)���,因此研究達(dá)到了主要 終點(diǎn)��。PP 集中,靶病變失敗的發(fā)生率為 5.1% [3.8%�����,6.9%]�, 顯著低于 11.9%的性能目標(biāo)值(p<0.0001)。?
(2)次要評(píng)價(jià)指標(biāo)?
即刻成功:試驗(yàn)組和對(duì)照組的病變成功率����、器械成功率、 手 術(shù) 成 功 率 和 器 械 特 定 的 手 術(shù) 成 功 率 分 別 為 96.4% (1066/1106)、95.5%(1056/1106)�����、93.2%(794/852)和 92.3% (786/852)�����。在 12 個(gè)月時(shí)�����,分評(píng)臨床終點(diǎn)結(jié)果如下:主要心臟不良事件(MACE)(死亡���、心肌梗死(Q 波或非 Q 波)�,或臨床驅(qū)動(dòng)的通過(guò)介入方法或手術(shù)方法進(jìn)行的靶病變血 運(yùn)重建:6.1%(52/850)���。?
全因死亡(心源性����、非心源性):0.9%(8/850)�;心源性死亡:0.4%(3/850);非心源性死亡:0.6%(5/850)����。心肌梗死(MI):所有心肌梗死:3.4%(29/850)��;靶血管 心肌梗死(TVMI):3.3%(28/850)�,Q-波:0.6%(5/850)�����,非 Q-波:2.8%(24/850)��。臨床驅(qū)動(dòng)的血運(yùn)重建:靶病變血運(yùn)重建(TLR):2.6% (22/850)���;靶血管血運(yùn)重建(TVR):3.2%(27/850)���;非靶血 管血運(yùn)重建(non-TVR):1.1%(9/850)。?
靶血管失?��。═VF)(心源性死亡、靶血管心肌梗死或者臨 床驅(qū)動(dòng)的靶血管血運(yùn)重建):5.9%(50/850)���。支架血栓(ST)(根據(jù) ARC 定義)明確的/很可能的:0.4% (3/850)�����;明確的支架血栓:0.2%(2/850)���;很可能的支架血栓:0.1%(1/850)���;可能的支架血栓:0.2%(2/850)。此外�,申請(qǐng)人提交了特殊規(guī)格產(chǎn)品包括 2.0mm,4.5-5.0mm 產(chǎn)品的臨床試驗(yàn)資料��,試驗(yàn)設(shè)計(jì)均采用單組研究�,樣本量分別 為 101 例、101 例���,主要評(píng)價(jià)指標(biāo) 12 個(gè)月靶病變失敗率為 5.0%����, 10.9%�����。高于預(yù)先設(shè)定的目標(biāo)值����。四��、產(chǎn)品受益風(fēng)險(xiǎn)判定 該產(chǎn)品臨床使用為適用人群帶來(lái)的主要受益為改善有癥狀 冠狀動(dòng)脈疾病患者的管腔直徑����。根據(jù)申請(qǐng)人提供的申報(bào)資料��,經(jīng)綜合評(píng)價(jià)����,在目前認(rèn)知水平上,認(rèn)為該產(chǎn)品的上市為適用人群帶來(lái)的受益大于風(fēng)險(xiǎn)�����。為 保證用械安全����,基于對(duì)主要剩余風(fēng)險(xiǎn)的規(guī)避,需在說(shuō)明書(shū)中提 示以下信息:?
該產(chǎn)品適用于符合進(jìn)行經(jīng)皮腔內(nèi)冠狀動(dòng)脈成形術(shù)(PTCA)�, 參考血管直徑為 2.0mm 至 5.0mm,病變長(zhǎng)度≤38mm 的患者擴(kuò) 大原發(fā)性冠狀動(dòng)脈狹窄的血管直徑。?
目前尚不清楚佐他莫司(Zotarolimus)的長(zhǎng)期影響?;颊弑┞队谒幬锖途酆衔锵到y(tǒng)的程度與支架數(shù)量和植入的 支架長(zhǎng)度直接相關(guān)。由于使用此器械存在與潛在的不良事件相關(guān)的風(fēng)險(xiǎn)��,因此 在選擇患者時(shí)必須謹(jǐn)慎正確。藥物支架的長(zhǎng)期療效和植入后的 相關(guān)風(fēng)險(xiǎn)還未知�����,植入器械前對(duì)患者進(jìn)行風(fēng)險(xiǎn)/益處評(píng)估時(shí)應(yīng)考 慮這些未知的風(fēng)險(xiǎn)�。?
使用適當(dāng)?shù)目鼓齽⒖寡“逅幒凸跔顒?dòng)脈擴(kuò)張劑治療對(duì) 于支架成功植入非常重要�����。請(qǐng)參閱最新的指南��。只有接受過(guò)相應(yīng)培訓(xùn)的醫(yī)生才能進(jìn)行支架植入手術(shù)�����。支架植入只能在具備可隨時(shí)進(jìn)行緊急冠狀動(dòng)脈搭橋手術(shù)條 件的醫(yī)院進(jìn)行�����。
植入后如果發(fā)生再狹窄����,可能需要反復(fù)擴(kuò)張含有支架的動(dòng) 脈節(jié)段。重復(fù)擴(kuò)張已經(jīng)內(nèi)皮化冠狀動(dòng)脈支架的長(zhǎng)期后果目前未 知��。雖然沒(méi)有具體的臨床數(shù)據(jù),但他克莫司之類的藥物可與相 同的結(jié)合蛋白(FKBP)作用�����,干擾佐他莫司(Zotarolimus)的療效���。?
佐他莫司(Zotarolimus)通過(guò)人細(xì)胞色素 P450 酶 CYP3A4 代謝�。CYP3A4 強(qiáng)抑制劑(如酮康唑)可使佐他莫司(Zotarolimus)作用 劑量升高到產(chǎn)生全身影響的水平�����,特別是在植入多個(gè)支架時(shí)���。如果患者同時(shí)接受全身免疫抑制治療�,則應(yīng)考慮佐他莫司 (Zotarolimus)劑量升高產(chǎn)生全身影響��。本產(chǎn)品對(duì)孕婦���、哺乳期女性或準(zhǔn)備生育的男性尚未進(jìn)行充 分和有良好對(duì)照的研究��。動(dòng)物生殖研究顯示會(huì)產(chǎn)生胚胎致死的 胚胎毒性����。
不建議準(zhǔn)備懷孕、已經(jīng)懷孕或正在哺乳期的女性使 用 Resolute Onyx 支架���。雄性大鼠研究表明會(huì)產(chǎn)生與劑量相關(guān)的 可逆的睪丸毒性。當(dāng)需要植入多個(gè)支架時(shí)����,支架的材料成分應(yīng)該相近。植入 多個(gè)不同材料制成的支架時(shí)���,其相互接觸可能會(huì)升高產(chǎn)生腐蝕 的可能性��。將鈷合金和鉑銥合金的合成材料支架(Medtronic Resolute Onyx 支架平臺(tái))與不銹鋼合金支架(Boston Scientific Liberte?)配合使用進(jìn)行體外腐蝕測(cè)試�,所獲得的數(shù)據(jù)未表明該應(yīng)用會(huì)帶來(lái)升高體內(nèi)腐蝕的風(fēng)險(xiǎn)�。Resolute Onyx 支架與其他藥物洗脫支架的相互作用尚未進(jìn) 行評(píng)估,應(yīng)當(dāng)盡可能避免同時(shí)使用��。使用Resolute Onyx支架直接植入支架和隱靜脈移植血管植 入支架的安全性和有效性尚未確定�����。?
植入可能造成植入支架血管遠(yuǎn)端和/或近端的夾層�,并導(dǎo)致 急性閉塞,而需要進(jìn)行其它的介入手術(shù)(例如 CABG [冠狀動(dòng)脈 搭橋]、二次球囊擴(kuò)張或放置其他支架)���。放置支架可能會(huì)降低側(cè)支血管的通暢性��。禁止對(duì) Resolute Onyx 支架進(jìn)行任何直接的操作(如:轉(zhuǎn)動(dòng) 支架)或在進(jìn)行準(zhǔn)備和輸送支架之前�����,使之接觸液體����,因?yàn)樗?物涂層可能容易受損或使藥物提前洗脫�。切勿使裝置接觸有機(jī)溶劑(如酒精或洗滌劑)或使用有機(jī) 溶劑擦拭本產(chǎn)品。請(qǐng)勿彎曲或扭結(jié)海波管����。如果出現(xiàn)扭結(jié),切勿試圖掰直扭 結(jié)的導(dǎo)管桿或海波管�����。掰直扭結(jié)的金屬桿可能導(dǎo)致桿破損�。切勿將支架從支架輸送系統(tǒng)上取下,因?yàn)檫@樣可能損壞支 架與聚合物體系和/或?qū)е轮Ъ芩ㄈ?����。Resolute Onyx 佐他莫司 (Zotarolimus)洗脫冠脈支架系統(tǒng)作為一個(gè)完整的系統(tǒng)進(jìn)行操作。支架不能安裝至另一個(gè)輸送裝置上�����。
血管內(nèi)超聲(IVUS)導(dǎo)管��、冠狀動(dòng)脈導(dǎo)絲���、球囊導(dǎo)管或任何 其他裝置穿過(guò)最近放置的支架時(shí),必須非常謹(jǐn)慎�����,避免損壞支 架的放置����、并置、Resolute Onyx 支架的藥物涂層和/或幾何形狀�����。Resolute Onyx 支架輸送系統(tǒng)不應(yīng)與其他任何支架配合使用 或用于植入后的擴(kuò)張���。過(guò)早停用處方中的抗血小板藥物會(huì)增加血栓形成�����、心肌梗 塞或死亡的風(fēng)險(xiǎn)�。?
Resolute Onyx 支架禁止用于:對(duì)阿斯匹林、肝素�����、氯吡格雷���、噻氯吡定���、佐他莫司 (Zotarolimus)之類的 mTOR 抑制藥物(他克莫司、西羅莫司���、 依維莫司)或任何其他 mTOR 抑制劑類似物或衍生物�、聚合物���、 鈷�、鉻���、鎳��、鉬��、鉑銥或?qū)Ρ葎┏艋蜻^(guò)敏的患者���。不可采用抗血小板和/或抗凝療法的病人禁用���。經(jīng)診斷,病變部位會(huì)阻礙血管成形球囊完全擴(kuò)張或者支架 或支架輸送系統(tǒng)正確放置的患者�。?
使用冠狀動(dòng)脈支架�、IVUS(血管內(nèi)超聲設(shè)備)或 PCI(經(jīng) 皮冠狀動(dòng)脈介入)所引發(fā)的潛在不良事件按嚴(yán)重程度列出如下:?
? 動(dòng)脈瘤、假性動(dòng)脈瘤或動(dòng)靜脈瘺(AVF)?
? 急性手術(shù):外周血管或冠狀動(dòng)脈搭橋?
? 中風(fēng)/短暫性腦缺血發(fā)作(TIA)?
? 冠狀動(dòng)脈閉塞、穿孔��、破裂或剝離?
? 血栓(急性����、亞急性���、晚期或極晚期)?
? 過(guò)敏反應(yīng)(對(duì)對(duì)比劑、抗血小板治療和支架系統(tǒng)-材料����、 藥物或聚合物涂層)
發(fā)生上面列出的并發(fā)癥可能需要重新進(jìn)行插管和/或經(jīng)皮冠 狀動(dòng)脈介入����、緊急搭橋手術(shù),并可能導(dǎo)致心肌梗死或死亡�����。
下 列副作用/并發(fā)癥可能與佐他莫司(Zotarolimus)的使用(但不限 于)相關(guān):?
BioLinx?聚合物的副作用/并發(fā)癥與其他支架涂層相同�����,可 能包括但不限于以下各項(xiàng):?
? 支架植入點(diǎn)出現(xiàn)局灶性炎癥?
綜合評(píng)價(jià)意見(jiàn)?
本申報(bào)產(chǎn)品屬于同品種首個(gè)產(chǎn)品首次申報(bào)醫(yī)療器械����。申請(qǐng) 人的注冊(cè)申報(bào)資料符合現(xiàn)行要求,依據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國(guó)務(wù)院令第 739 號(hào))�����、《醫(yī)療器械注冊(cè)管理辦法》(國(guó)家食 品藥品監(jiān)督管理總局令第 4 號(hào))等相關(guān)醫(yī)療器械法規(guī)與配套規(guī) 章,經(jīng)系統(tǒng)評(píng)價(jià)后�����,建議準(zhǔn)予注冊(cè)��。?
2022 年 11 月 10 日
