
各有關(guān)單位:
根據(jù)國(guó)家藥品監(jiān)督管理局2022年度醫(yī)療器械注冊(cè)審查指導(dǎo)原則制修訂計(jì)劃的有關(guān)要求��,我中心組織編制了《曲霉核酸檢測(cè)試劑注冊(cè)審查指導(dǎo)原則(征求意見(jiàn)稿)》(附件1)�����,現(xiàn)向社會(huì)公開(kāi)征求意見(jiàn)�。
如有意見(jiàn)和建議���,請(qǐng)?zhí)顚?xiě)意見(jiàn)反饋表(附件2)����,以電子郵件的形式于2022年12月12日前反饋至我中心�。
聯(lián)系人及聯(lián)系方式:
聯(lián)系人:韓昭昭,徐超�,李岑
聯(lián)系電話(huà):010-86452876,010-86452539����,010-86452861
email:licen@cmde.org.cn
?
附件:
1.曲霉核酸檢測(cè)試劑注冊(cè)審查指導(dǎo)原則(征求意見(jiàn)稿)
2.意見(jiàn)反饋表
國(guó)家藥品監(jiān)督管理局
醫(yī)療器械技術(shù)審評(píng)中心
2022年11月28日
附件1:
曲霉核酸檢測(cè)試劑注冊(cè)審查指導(dǎo)原則
(征求意見(jiàn)稿)
本指導(dǎo)原則旨在指導(dǎo)注冊(cè)申請(qǐng)人對(duì)曲霉核酸檢測(cè)試劑注冊(cè)申報(bào)資料的準(zhǔn)備及撰寫(xiě)�����,同時(shí)也為技術(shù)審評(píng)部門(mén)提供參考���。
本指導(dǎo)原則是對(duì)曲霉核酸檢測(cè)試劑的一般要求,申請(qǐng)人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用�����。若不適用�����,需具體闡述理由及相應(yīng)的科學(xué)依據(jù)�����,并依據(jù)產(chǎn)品的具體特性對(duì)注冊(cè)申報(bào)資料的內(nèi)容進(jìn)行充實(shí)和細(xì)化����。
本指導(dǎo)原則是供注冊(cè)申請(qǐng)人和技術(shù)審評(píng)人員使用的指導(dǎo)性文件���,但不包括審評(píng)審批所涉及的行政事項(xiàng)���,亦不作為法規(guī)強(qiáng)制執(zhí)行���,應(yīng)在遵循相關(guān)法規(guī)的前提下使用本指導(dǎo)原則。如果有能夠滿(mǎn)足相關(guān)法規(guī)要求的其他方法�,也可以采用,但是需要提供詳細(xì)的研究資料和驗(yàn)證資料�����。
本指導(dǎo)原則是在現(xiàn)行法規(guī)和標(biāo)準(zhǔn)體系以及當(dāng)前認(rèn)知水平下制定���,隨著法規(guī)和標(biāo)準(zhǔn)的不斷完善����,以及科學(xué)技術(shù)的不斷發(fā)展����,相關(guān)內(nèi)容也將適時(shí)進(jìn)行調(diào)整。
真菌的生物分類(lèi)包括門(mén)�、綱、目��、科、屬等��,本指導(dǎo)原則對(duì)真菌的分類(lèi)描述如無(wú)特殊說(shuō)明均為“種”�,如指“目”或“屬”等均已在原文中明確。
本指導(dǎo)原則適用于采用實(shí)時(shí)熒光PCR法�,對(duì)肺泡灌洗液���、痰液����、組織樣本等中的曲霉核酸進(jìn)行體外定性檢測(cè)的試劑���,包含曲霉菌屬(Aspergillus)通用型核酸檢測(cè)試劑和曲霉菌屬中一個(gè)或多個(gè)菌種的檢測(cè)試劑��。檢測(cè)結(jié)果臨床上用于肺曲霉病的輔助診斷����。
對(duì)于采用其他方法學(xué)的曲霉核酸檢測(cè)試劑�����,可能部分要求不完全適用或本文所述內(nèi)容不夠全面���,申請(qǐng)人應(yīng)參照本指導(dǎo)原則����,根據(jù)產(chǎn)品特性對(duì)適用部分進(jìn)行評(píng)價(jià)���,并補(bǔ)充其他的評(píng)價(jià)資料��。
本指導(dǎo)原則適用于曲霉核酸檢測(cè)試劑注冊(cè)申請(qǐng)和變更注冊(cè)申請(qǐng)的情形��。本指導(dǎo)原則針對(duì)曲霉核酸檢測(cè)試劑注冊(cè)申報(bào)資料中的部分內(nèi)容進(jìn)行撰寫(xiě)�,其他未盡事宜應(yīng)當(dāng)符合《關(guān)于公布體外診斷試劑注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》(國(guó)家藥品監(jiān)督管理局公告2021年第122號(hào))等相關(guān)法規(guī)的要求���,同時(shí)建議參考《定性檢測(cè)試劑分析性能評(píng)估注冊(cè)審查指導(dǎo)原則》等適用的技術(shù)文件要求�����。
1.產(chǎn)品名稱(chēng)及分類(lèi)編碼
產(chǎn)品名稱(chēng)應(yīng)體現(xiàn)檢測(cè)目標(biāo)病原體,如曲霉核酸檢測(cè)試劑盒(實(shí)時(shí)熒光PCR法)���、煙曲霉菌核酸檢測(cè)試劑盒(實(shí)時(shí)熒光PCR法)等�。該產(chǎn)品按照第三類(lèi)體外診斷試劑管理,分類(lèi)編碼為6840��。
2.其他信息還包括產(chǎn)品列表���、關(guān)聯(lián)文件���、申報(bào)前與監(jiān)管機(jī)構(gòu)的聯(lián)系情況和溝通記錄以及符合性聲明等文件。
綜述資料主要包括概述�、產(chǎn)品描述����、預(yù)期用途��、申報(bào)產(chǎn)品上市歷史及其他需說(shuō)明的內(nèi)容���。應(yīng)詳細(xì)說(shuō)明產(chǎn)品所采用的技術(shù)原理及檢測(cè)流程����。明確產(chǎn)品檢測(cè)靶基因����,提供引物和探針的設(shè)計(jì)依據(jù)�����。提供核酸提取(手工和自動(dòng)提取方式應(yīng)分別明確)和PCR擴(kuò)增的時(shí)間��,提供不同適用機(jī)型的檢測(cè)通量(如適用)����。與已上市同類(lèi)產(chǎn)品或前代產(chǎn)品進(jìn)行比較,比較內(nèi)容包括樣本類(lèi)型���,檢測(cè)原理����,檢測(cè)靶基因�,組成成分,內(nèi)標(biāo)����,質(zhì)控品,判讀規(guī)則���,分析性能和臨床性能等����。提供樣本類(lèi)型選擇的依據(jù)。提供產(chǎn)品預(yù)期用途和臨床適應(yīng)證���,明確適用人群的情況�。
分析性能評(píng)估所用樣本的基本信息均需明確�����,例如樣本來(lái)源��、樣本類(lèi)型�、采集和處理方式、稀釋方式���、定值過(guò)程及數(shù)據(jù)等���。研究中采用的曲霉陽(yáng)性樣本,應(yīng)采用科學(xué)合理的方法確定其陰陽(yáng)性和濃度水平�����,提交具體的試驗(yàn)資料,并明確培養(yǎng)和鑒定結(jié)果�����。分析性能評(píng)估用樣本均應(yīng)采用真實(shí)樣本����,如涉及稀釋后檢測(cè),應(yīng)采用與適用樣本類(lèi)型一致的陰性基質(zhì)�����。也可采用人工構(gòu)建樣本(如質(zhì)粒)進(jìn)行研究��,此部分研究可作為額外研究資料提交注冊(cè)���。對(duì)于各項(xiàng)性能中采用的樣本,在下述各項(xiàng)性能研究資料中分別提供樣本信息列表����。檢出限和包容性研究中所用樣本應(yīng)相互獨(dú)立。
應(yīng)對(duì)樣本穩(wěn)定性進(jìn)行詳細(xì)研究����,包括采集后未經(jīng)處理的樣本,加入不同裂解液/消化液的樣本,滅活處理后的樣本����,研究?jī)?nèi)容包括冷藏保存時(shí)間,冷凍保存時(shí)間�����,凍融次數(shù)等���。
如產(chǎn)品適用不同的樣本類(lèi)型��,應(yīng)對(duì)每種樣本類(lèi)型進(jìn)行穩(wěn)定性研究���。
如核酸提取液可不立即進(jìn)行檢測(cè),還需對(duì)核酸提取液的保存條件和穩(wěn)定性進(jìn)行研究�����。
根據(jù)主要原材料研究資料中的企業(yè)參考品設(shè)置情況�,采用三批產(chǎn)品對(duì)企業(yè)參考品進(jìn)行檢驗(yàn)并提供詳細(xì)的試驗(yàn)數(shù)據(jù)。
應(yīng)對(duì)精密度指標(biāo)�,如標(biāo)準(zhǔn)差或變異系數(shù)等的評(píng)價(jià)標(biāo)準(zhǔn)做出合理要求。應(yīng)考慮運(yùn)行�、時(shí)間、操作者、儀器�、試劑批次和地點(diǎn)等影響精密度的條件,設(shè)計(jì)合理的精密度試驗(yàn)方案進(jìn)行評(píng)價(jià)���。精密度評(píng)價(jià)試驗(yàn)應(yīng)包含核酸提取步驟���。設(shè)定合理的精密度評(píng)價(jià)周期,例如為期至少20天的檢測(cè)�����。對(duì)檢測(cè)數(shù)據(jù)進(jìn)行統(tǒng)計(jì)分析����,獲得重復(fù)性�、實(shí)驗(yàn)室內(nèi)精密度、實(shí)驗(yàn)室間精密度�、批間精密度等結(jié)果。
采用培養(yǎng)菌株進(jìn)行精密度評(píng)價(jià)���,應(yīng)至少包含3個(gè)水平:陰性樣本�����、臨界陽(yáng)性樣本�、中/強(qiáng)陽(yáng)性樣本,并根據(jù)產(chǎn)品特性設(shè)定適當(dāng)?shù)木芏纫?,例如?/span>
陰性樣本:不含待測(cè)物,陰性檢出率應(yīng)為100%(n≥20)�����。
臨界陽(yáng)性樣本:待測(cè)物濃度略高于試劑盒的檢出限���,陽(yáng)性檢出率應(yīng)≥95%(n≥20)��。
中/強(qiáng)陽(yáng)性樣本:待測(cè)物濃度呈中度到強(qiáng)陽(yáng)性�,陽(yáng)性檢出率為100%且Ct值的CV≤5%(n≥20)�。
1.4.1采用生物信息學(xué)方法對(duì)產(chǎn)品檢測(cè)的包容性進(jìn)行研究,研究應(yīng)覆蓋已公布的曲霉核酸序列����。
1.4.2根據(jù)試劑盒檢測(cè)范圍選擇進(jìn)行包容性驗(yàn)證的曲霉菌種,使用具有不同時(shí)間和區(qū)域特征性的不同來(lái)源的臨床樣本或培養(yǎng)菌株進(jìn)行驗(yàn)證���,每種菌種至少使用3例樣本���,研究應(yīng)包括檢出限和重復(fù)性的驗(yàn)證����。
對(duì)于曲霉菌屬通用型核酸檢測(cè)試劑�,樣本應(yīng)覆蓋已知曲霉菌屬中的主要致病菌種,至少包含煙曲霉菌(A.fumigatus)�����、黃曲霉菌(A.flavus)��、黑曲霉菌(A.niger)���、土曲霉菌(A.terreus)���、構(gòu)巢曲霉菌(A.nidulans)、圖賓根曲霉菌(A.tubingensis)��、米曲霉菌(A.oryzae)�、聚多曲霉菌(A.sydowii)����、雜色曲霉菌(A.versicolor)、亮白曲霉菌(A.candidus)�����、灰綠曲霉菌(A.glaucus)。
根據(jù)試劑盒檢測(cè)范圍選擇進(jìn)行檢出限驗(yàn)證的曲霉菌種���。如為曲霉菌屬通用型核酸檢測(cè)試劑�,應(yīng)至少對(duì)煙曲霉菌�����、黃曲霉菌��、黑曲霉菌�����、土曲霉菌�����、構(gòu)巢曲霉菌分別進(jìn)行檢出限的確定和驗(yàn)證��。
建議使用培養(yǎng)菌株系列稀釋于與適用樣本一致的陰性基質(zhì)中���,進(jìn)行檢出限的確定�����。每個(gè)濃度梯度重復(fù)檢測(cè)�����,記錄不同濃度檢出的結(jié)果�����,采用適當(dāng)?shù)哪P停ㄈ鏟robit分析)和分析方法����,將具有95%陽(yáng)性檢出率的最低濃度水平作為確定的檢出限。建議申請(qǐng)人采用孢子/mL作為菌株濃度的表示方式�。除此之外,申請(qǐng)人還應(yīng)采用數(shù)字PCR�、標(biāo)準(zhǔn)曲線(xiàn)(通過(guò)標(biāo)準(zhǔn)物質(zhì)或構(gòu)建質(zhì)粒繪制標(biāo)準(zhǔn)曲線(xiàn))等方法進(jìn)行菌株核酸濃度的確認(rèn),以copies/mL作為毒株濃度的表示方式�。應(yīng)明確每份菌株的來(lái)源、濃度�、制備方法等信息。
建議使用至少5份不同來(lái)源的最低檢測(cè)限水平的培養(yǎng)菌株�,進(jìn)行至少20次的重復(fù)驗(yàn)證�����,陽(yáng)性檢出率不低于95%。注冊(cè)申請(qǐng)人應(yīng)能夠提供用于最低檢測(cè)限驗(yàn)證的各個(gè)菌株的來(lái)源����、制備方法及濃度等信息。
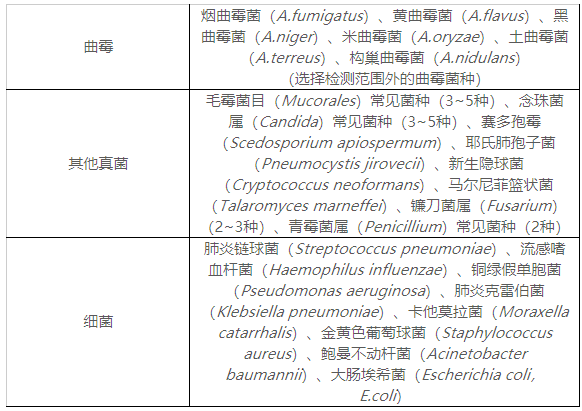
1.6.1.1交叉反應(yīng)驗(yàn)證的病原體種類(lèi)主要考慮以下幾方面:近緣菌�����、易引起相同或相似的臨床癥狀微生物�����、感染部位附近的定植菌等�,研究樣本具體見(jiàn)表1。
1.6.1.2建議在病毒和細(xì)菌感染的醫(yī)學(xué)相關(guān)水平進(jìn)行交叉反應(yīng)的驗(yàn)證���。通常����,細(xì)菌感染的水平為106?CFU/mL或更高����,病毒為105?PFU/mL或更高�����。
1.6.1.3申請(qǐng)人應(yīng)提供所有用于交叉反應(yīng)驗(yàn)證的微生物的來(lái)源�、種屬/型別和濃度確認(rèn)等試驗(yàn)資料��。
表1 需進(jìn)行交叉反應(yīng)研究的病原體
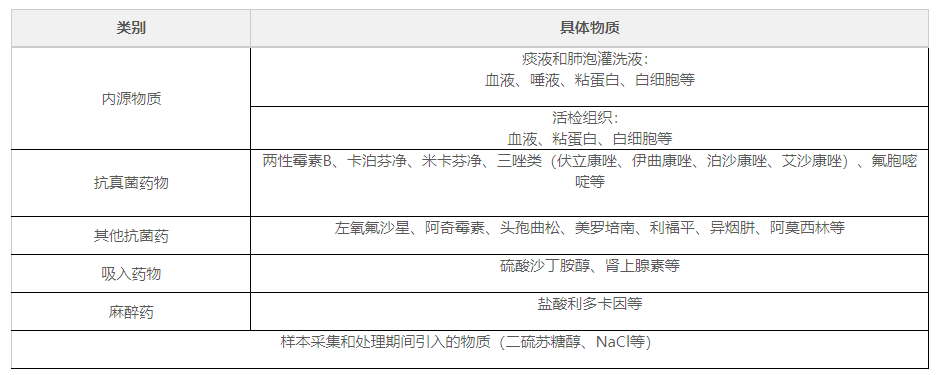
應(yīng)根據(jù)所采集樣本類(lèi)型�����,針對(duì)可能存在的內(nèi)源/外源物質(zhì)干擾情況進(jìn)行驗(yàn)證�����。建議申請(qǐng)人在每種干擾物質(zhì)的潛在最大濃度(“最差條件”)條件下進(jìn)行試驗(yàn)�,檢測(cè)包含臨界陽(yáng)性水平在內(nèi)的曲霉樣本。對(duì)結(jié)果進(jìn)行合理的統(tǒng)計(jì)分析�,對(duì)比添加干擾物質(zhì)前后的 Ct?值差異。檢測(cè)的潛在干擾物包括樣本中的原有物質(zhì)及在樣本采集和處理期間引入的物質(zhì)���。用于干擾試驗(yàn)研究的物質(zhì)具體見(jiàn)表2�����。
表2 用于干擾試驗(yàn)研究的物質(zhì)
在進(jìn)行核酸檢測(cè)之前����,建議有核酸提取/純化步驟�����。該步驟的目的為有效破環(huán)真菌細(xì)胞壁����,分離出目的核酸,并應(yīng)具有相應(yīng)的純化作用�,盡可能去除PCR抑制物。
研究確定核酸提取方法�����,闡述核酸提取原理���,提交提取方案選擇研究資料�����。對(duì)配合使用的所有核酸提取試劑進(jìn)行提取核酸純度����、濃度、提取效率的研究��,并與質(zhì)量較好的核酸提取試劑進(jìn)行平行比對(duì)����。若產(chǎn)品適用兩種或以上核酸提取試劑,則每一種核酸提取試劑均需配合檢測(cè)試劑至少進(jìn)行抗干擾���、再現(xiàn)性和檢出限的驗(yàn)證�����,如果配套核酸提取試劑提取原理存在差異��,還需額外進(jìn)行檢出限的建立研究����。
1.8.1.1樣本采集方式的選擇和樣本采集量的要求��。
1.8.1.2樣本采集時(shí)間點(diǎn)的選擇:是否受病程��、臨床癥狀�����、用藥情況等因素的影響。
1.8.1.3樣本處理方式的選擇:研究樣本適用的滅活方式�,消化方式(如適用)、保存方式�����,包括樣本用量����、保存溫度�����、時(shí)間等�。
研究確定最佳核酸提取和反應(yīng)體系,包括核酸提取用的樣本體積��、洗脫體積和PCR加樣體積���、各種酶濃度�����、引物/探針濃度����、dNTP濃度、陽(yáng)離子濃度及反應(yīng)各階段溫度��、時(shí)間��、循環(huán)數(shù)等�����。
提交不同適用機(jī)型基線(xiàn)和閾值循環(huán)數(shù)的確定資料����。不同適用機(jī)型的反應(yīng)條件如果有差異應(yīng)分別詳述,并提交驗(yàn)證資料��。
申報(bào)試劑的穩(wěn)定性主要包括實(shí)時(shí)穩(wěn)定性(有效期)����、運(yùn)輸穩(wěn)定性、開(kāi)瓶穩(wěn)定性及凍融次數(shù)限制等研究����,申請(qǐng)人可根據(jù)實(shí)際需要選擇合理的穩(wěn)定性研究方案�。穩(wěn)定性研究資料應(yīng)包括具體的實(shí)施方案���、詳細(xì)的研究數(shù)據(jù)以及統(tǒng)計(jì)分析結(jié)論�����。對(duì)于實(shí)時(shí)穩(wěn)定性研究�,應(yīng)提供至少三批產(chǎn)品在實(shí)際儲(chǔ)存條件下保存至成品有效期后的研究資料���。
陽(yáng)性判斷值確定資料主要指對(duì)申報(bào)產(chǎn)品核酸檢測(cè)的Ct值,即結(jié)果判斷的臨界值進(jìn)行確認(rèn)的資料�。陽(yáng)性判斷值研究樣本來(lái)源應(yīng)為預(yù)期人群,如臨床需要進(jìn)行肺曲霉病診斷或鑒別診斷的病例����,并考慮不同年齡、地域等因素���,盡可能考慮樣本來(lái)源的多樣性�����、代表性�,盡量納入較多弱陽(yáng)性和高陰性水平的樣本。對(duì)于曲霉菌屬通用型核酸檢測(cè)試劑應(yīng)納入不同曲霉菌種樣本進(jìn)行研究�,并分別進(jìn)行統(tǒng)計(jì)分析,建議研究的菌種類(lèi)型與檢出限研究要求相同�����。建議申請(qǐng)人采用受試者工作特征(ROC)曲線(xiàn)的方式確定申報(bào)試劑用于結(jié)果判斷的臨界值����,明確檢測(cè)結(jié)果判定依據(jù),提交陽(yáng)性判斷值研究所用樣本的背景信息列表����,至少包括性別、年齡���、臨床診斷信息���、樣本來(lái)源機(jī)構(gòu)、檢測(cè)結(jié)果等信息�。如判定值存在灰區(qū),應(yīng)提供灰區(qū)的確認(rèn)資料����。
另外�����,考慮建立陽(yáng)性判斷值時(shí)使用的臨床樣本對(duì)于目標(biāo)人群的代表性����,建議通過(guò)臨床評(píng)價(jià)進(jìn)一步驗(yàn)證和確認(rèn)陽(yáng)性判斷值的準(zhǔn)確性�。
如果產(chǎn)品適用不同樣本類(lèi)型,需要對(duì)各樣本類(lèi)型進(jìn)行陽(yáng)性判斷值的驗(yàn)證��。
提供內(nèi)標(biāo)檢測(cè)結(jié)果范圍的確定方法和研究資料����。
該類(lèi)產(chǎn)品的主要原材料包括引物、探針��、酶��、dNTP���、核酸分離/純化組分(如有)、質(zhì)控品����、參考品等��。應(yīng)提供主要原材料的選擇與來(lái)源��、制備過(guò)程��、質(zhì)量控制標(biāo)準(zhǔn)等相關(guān)研究資料����、質(zhì)控品的定值試驗(yàn)資料等����。如主要原材料為企業(yè)自制,應(yīng)提供其詳細(xì)制備過(guò)程��;如主要原材料源于外購(gòu)��,應(yīng)提供資料包括:選擇該原材料的依據(jù)及對(duì)比篩選試驗(yàn)資料����、供貨方提供的質(zhì)量標(biāo)準(zhǔn)、出廠檢驗(yàn)報(bào)告��,以及該原材料到貨后的質(zhì)量檢驗(yàn)資料���。供應(yīng)商應(yīng)進(jìn)行必要的篩選或評(píng)價(jià)����,供應(yīng)商應(yīng)固定,不得隨意更換�。
4.1.1引物和探針:應(yīng)詳述引物和探針的設(shè)計(jì)原則,提供引物����、探針核酸序列、靶序列的基因位點(diǎn)及兩者的對(duì)應(yīng)情況�����。建議設(shè)計(jì)兩套或多套引物�����、探針以供篩選���,通過(guò)序列比對(duì)和功能性試驗(yàn)等方式,對(duì)產(chǎn)品檢出限�、包容性和特異性進(jìn)行評(píng)價(jià)。通過(guò)篩選確定最佳的引物和探針組合�����。引物、探針的質(zhì)量標(biāo)準(zhǔn)應(yīng)至少包括序列準(zhǔn)確性�����、純度����、濃度及功能性試驗(yàn)等。
4.1.2脫氧三磷酸核苷(dNTP):應(yīng)提供對(duì)其純度�、濃度、功能性等的詳細(xì)驗(yàn)證資料�����。
4.1.3酶:需要的酶主要包括DNA聚合酶����、尿嘧啶DNA糖基化酶等,應(yīng)分別明確酶性能的要求�����,對(duì)酶活性�����、功能性等進(jìn)行評(píng)價(jià)和驗(yàn)證。
試劑盒一般包含陰性質(zhì)控品和陽(yáng)性質(zhì)控品�。陽(yáng)性質(zhì)控品應(yīng)包含試劑盒檢測(cè)的靶序列,可采用滅活曲霉培養(yǎng)物�。質(zhì)控品需參與樣本處理、核酸的平行提取和檢測(cè)的全過(guò)程���,以對(duì)整個(gè)提取和PCR擴(kuò)增過(guò)程��、試劑/設(shè)備�����、交叉污染等環(huán)節(jié)進(jìn)行合理質(zhì)量控制��。提交試劑盒質(zhì)控品有關(guān)原料選擇�、制備��、定值過(guò)程��、濃度范圍等試驗(yàn)資料�����,對(duì)質(zhì)控品的檢測(cè)結(jié)果Ct值范圍做出明確的要求�����。
內(nèi)標(biāo)�,又稱(chēng)內(nèi)對(duì)照,可對(duì)管內(nèi)抑制導(dǎo)致的假陰性結(jié)果進(jìn)行質(zhì)量控制��,應(yīng)與靶核酸一同提取及擴(kuò)增���。申請(qǐng)人需對(duì)內(nèi)標(biāo)的引物����、探針設(shè)計(jì)和相關(guān)反應(yīng)體系的濃度做精確驗(yàn)證��,既要保證內(nèi)標(biāo)熒光通道呈明顯的陽(yáng)性曲線(xiàn)又要盡量降低對(duì)靶基因檢測(cè)造成的抑制����。明確內(nèi)標(biāo)的檢測(cè)結(jié)果Ct值范圍。建議科學(xué)設(shè)置內(nèi)標(biāo)�,對(duì)待測(cè)樣本的取樣質(zhì)量、試劑的反應(yīng)體系進(jìn)行監(jiān)控���。
該類(lèi)產(chǎn)品的企業(yè)參考品一般包括陽(yáng)性參考品���、陰性參考品����、檢出限參考品和精密度參考品�。應(yīng)根據(jù)產(chǎn)品性能驗(yàn)證的實(shí)際需要設(shè)置企業(yè)參考品。
應(yīng)提交企業(yè)參考品的原料來(lái)源�����、選擇���、制備����、陰陽(yáng)性及濃度確認(rèn)方法或試劑等相關(guān)驗(yàn)證資料��。企業(yè)參考品應(yīng)采用臨床樣本���,或者使用培養(yǎng)物加入陰性基質(zhì)����。企業(yè)參考品的設(shè)置建議如下:
陽(yáng)性參考品:應(yīng)著重考慮不同來(lái)源的曲霉樣本和滴度要求�,應(yīng)至少選取不同病例來(lái)源的3個(gè)曲霉菌種樣本�。對(duì)于曲霉菌屬通用型核酸檢測(cè)試劑���,陽(yáng)性參考品應(yīng)至少包含煙曲霉菌、黃曲霉菌��、黑曲霉菌�����、土曲霉菌���,每個(gè)菌種包含不同病例來(lái)源的3個(gè)曲霉菌種樣本���。
陰性參考品:主要涉及對(duì)交叉反應(yīng)的驗(yàn)證情況,建議包括定植部位相同�����、引發(fā)癥狀相近的其他病原體��,包括檢測(cè)范圍外的曲霉菌種(煙曲霉菌���、黃曲霉菌���、黑曲霉菌�����、米曲霉菌�����、土曲霉菌�、構(gòu)巢曲霉菌)�、毛霉菌目常見(jiàn)菌種、念珠菌屬常見(jiàn)菌種����、賽多孢霉、耶氏肺孢子菌�、新生隱球菌、馬爾尼菲籃狀菌����、鐮刀菌屬、青霉菌屬��。
檢出限參考品:可采用95%陽(yáng)性檢出水平或略高于檢出限的水平���,如100%陽(yáng)性檢出水平�����。對(duì)于曲霉菌屬通用型核酸檢測(cè)試劑����,應(yīng)至少包含煙曲霉菌���、黃曲霉菌��、黑曲霉菌��、土曲霉菌���。
精密度參考品:應(yīng)包含略高于檢出限濃度水平的陽(yáng)性樣本。
介紹產(chǎn)品主要生產(chǎn)工藝��,可用流程圖結(jié)合文字的方式表述���。提交主要生產(chǎn)工藝的確定及優(yōu)化研究資料���。
該類(lèi)試劑應(yīng)通過(guò)臨床試驗(yàn)路徑進(jìn)行臨床評(píng)價(jià)���。臨床試驗(yàn)應(yīng)符合《體外診斷試劑注冊(cè)與備案管理辦法》《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》和《體外診斷試劑臨床試驗(yàn)技術(shù)指導(dǎo)原則》的要求,如相關(guān)法規(guī)��、文件有更新���,臨床試驗(yàn)應(yīng)符合更新后的要求��。下面僅說(shuō)明該類(lèi)產(chǎn)品臨床試驗(yàn)中應(yīng)關(guān)注的重點(diǎn)問(wèn)題��。
應(yīng)選擇具備相應(yīng)條件且按照規(guī)定備案的醫(yī)療器械臨床試驗(yàn)機(jī)構(gòu)開(kāi)展臨床試驗(yàn)����。肺曲霉病屬于呼吸系統(tǒng)染性疾病��,建議申請(qǐng)人在呼吸系統(tǒng)疾病及傳染病方面具有優(yōu)勢(shì)的臨床機(jī)構(gòu)開(kāi)展臨床試驗(yàn)���。臨床試驗(yàn)機(jī)構(gòu)數(shù)量應(yīng)不少于3家�,且具有分子生物學(xué)方法檢測(cè)的優(yōu)勢(shì)���,試驗(yàn)操作人員應(yīng)有足夠的時(shí)間熟悉檢測(cè)系統(tǒng)的各環(huán)節(jié)(儀器�����、試劑�、質(zhì)控及操作程序等),熟悉評(píng)價(jià)方案�����。在整個(gè)試驗(yàn)中�,試驗(yàn)體外診斷試劑和對(duì)比方法均應(yīng)處于有效的質(zhì)量控制下,最大限度保證試驗(yàn)數(shù)據(jù)的準(zhǔn)確性及可重復(fù)性�。
2.1.1對(duì)于已有同類(lèi)產(chǎn)品上市的,臨床試驗(yàn)應(yīng)選擇已上市的同類(lèi)產(chǎn)品作為對(duì)比試劑�,評(píng)價(jià)申報(bào)產(chǎn)品與已上市同類(lèi)產(chǎn)品的一致性���。對(duì)比試劑的選擇應(yīng)考慮檢測(cè)的曲霉范圍���、適用的樣本類(lèi)型、產(chǎn)品性能等方面應(yīng)與試驗(yàn)體外診斷試劑具有良好的可比性�����,選擇已上市同類(lèi)產(chǎn)品進(jìn)行臨床試驗(yàn)時(shí)��,對(duì)比試劑配套使用的核酸提取試劑應(yīng)滿(mǎn)足其說(shuō)明書(shū)要求����。針對(duì)不一致樣本處理����,病原體分離培養(yǎng)����、測(cè)序等方法進(jìn)一步確認(rèn)。
2.1.2對(duì)于尚無(wú)同類(lèi)產(chǎn)品上市的���,申請(qǐng)人可采用試驗(yàn)體外診斷試劑與核酸序列測(cè)定(Sanger測(cè)序)方法進(jìn)行對(duì)比試驗(yàn)����,評(píng)價(jià)兩種檢測(cè)方法的一致性���。同時(shí)還應(yīng)進(jìn)行部分與曲霉菌屬分離培養(yǎng)鑒定的對(duì)比試驗(yàn)���。以上兩方面評(píng)價(jià)結(jié)果結(jié)合起來(lái)共同論證試驗(yàn)體外診斷試劑的臨床性能。
臨床試驗(yàn)資料中應(yīng)對(duì)測(cè)序方法進(jìn)行詳細(xì)的介紹����,明確檢測(cè)過(guò)程中配套使用的核酸提取試劑,這對(duì)測(cè)序方法提交性能驗(yàn)證數(shù)據(jù),證明測(cè)序方法與試驗(yàn)體外診斷試劑的可比性��。如測(cè)序試驗(yàn)委托其他機(jī)構(gòu)完成�����,還應(yīng)提交由臨床試驗(yàn)機(jī)構(gòu)委托第三方機(jī)構(gòu)/實(shí)驗(yàn)室開(kāi)展相關(guān)試驗(yàn)的測(cè)序服務(wù)合同/協(xié)議����,提交相關(guān)機(jī)構(gòu)資質(zhì)和選擇依據(jù)。
2.2與臨床參考標(biāo)準(zhǔn)的比較研究
在上述比較研究的基礎(chǔ)上�,申請(qǐng)人還應(yīng)采用試驗(yàn)體外診斷試劑與肺曲霉病診斷的臨床參考標(biāo)準(zhǔn)進(jìn)行比較研究,評(píng)價(jià)試驗(yàn)體外診斷試劑的臨床性能���。肺曲霉病診斷的臨床參考標(biāo)準(zhǔn)可參考臨床公認(rèn)的侵襲性肺曲霉病�����、慢性肺曲霉病、變應(yīng)性支氣管肺曲霉病的診斷標(biāo)準(zhǔn)��。
侵襲性肺曲霉病的臨床診斷需要聯(lián)合臨床特征���、影像學(xué)表現(xiàn)���、微生物學(xué)證據(jù)三方面進(jìn)行綜合診斷�。臨床特征主要為具有一定曲霉感染危險(xiǎn)因素的人群���,臨床表現(xiàn)為不明原因的發(fā)熱和下呼吸道感染癥狀�����,經(jīng)充分的廣譜抗菌藥物治療無(wú)好轉(zhuǎn)�����;影響學(xué)表現(xiàn)符合血管侵襲性肺曲霉病和氣道侵襲性肺曲霉病的特征��;微生物證據(jù)包括:直接培養(yǎng)及鏡檢�、抗原��、抗體檢測(cè)等��。無(wú)菌性標(biāo)本通過(guò)培養(yǎng)或直接鏡檢發(fā)現(xiàn)曲霉菌絲可以達(dá)到確診��;由以上宿主因素及肺部影像學(xué)特征�����,在非無(wú)菌樣本中發(fā)現(xiàn)曲霉微生物證據(jù)可為臨床診斷肺曲霉病���;僅有臨床特征及影像學(xué)表現(xiàn)���,缺乏微生物證據(jù),考慮為擬診����;僅有臨床特征,無(wú)影響學(xué)及微生物學(xué)證據(jù)的考慮為排除病例�。
慢性肺曲霉病的診斷應(yīng)包括以下幾個(gè)方面:1.持續(xù)胸部影像學(xué)上的異常表現(xiàn),影像學(xué)上的表現(xiàn)為一個(gè)或多個(gè)空洞��,伴隨或不伴隨曲霉球或結(jié)節(jié)表現(xiàn)����。2.曲霉感染的直接證據(jù)或免疫學(xué)反應(yīng)。3.病程至少持續(xù)3個(gè)月�。
變應(yīng)性支氣管肺曲霉病診斷標(biāo)準(zhǔn):1.支氣管哮喘;2.目前存在或以前曾有肺部浸潤(rùn)�����;3.中心型支氣管擴(kuò)張�;4.外周血嗜酸性粒細(xì)胞增多;5.煙曲霉變應(yīng)原速發(fā)性皮膚試驗(yàn)陽(yáng)性����;6.煙曲霉變應(yīng)原沉淀抗體陽(yáng)性;7.血清抗曲霉特異性IgG抗體增高���;8.血清總IgE濃度增高����。上述條件綜合判斷進(jìn)行疾病的診斷��。
臨床試驗(yàn)的受試人群應(yīng)來(lái)自產(chǎn)品的預(yù)期適用人群�����,該產(chǎn)品的適用人群為臨床需要進(jìn)行肺曲霉病診斷或鑒別診斷的病例����。
曲霉是條件致病性真菌,全身或局部免疫缺陷的人群易發(fā)生曲霉感染�。臨床試驗(yàn)入組人群應(yīng)為易發(fā)生曲霉感染的人群如:粒細(xì)胞缺乏、血液系統(tǒng)惡性腫瘤���、器官移植���、遺傳或獲得性免疫缺陷等人群��。肺曲霉亦可發(fā)生在慢性阻塞性肺部疾病���、糖尿病等非粒細(xì)胞缺乏的人群,因此�,臨床試驗(yàn)也應(yīng)涵蓋上述人群。
病例入組過(guò)程中應(yīng)考慮涵蓋不同的肺曲霉病的患者���,如侵襲性肺曲霉病����、慢性肺曲霉?����。▎渭冃苑吻骨?�、慢性空洞性肺曲霉病�����、慢性纖維化性肺曲霉病���、曲霉結(jié)節(jié)�、亞急性侵襲性肺曲霉?。⒆儜?yīng)性支氣管肺曲霉病等��。
申請(qǐng)人在進(jìn)行臨床試驗(yàn)時(shí)還應(yīng)入組部分需要進(jìn)行鑒別診斷的等其他真菌感染患者�,此外臨床試驗(yàn)應(yīng)納入部分病原體載量較低的病例(其中包括接受抗真菌治療的患者)。
曲霉在自然界廣泛分布��,且僅有少數(shù)健康人感染曲霉后致病���,臨床試驗(yàn)不建議入組一般健康人群及機(jī)體免疫功能(狀態(tài))正常的人群�����。
曲霉核酸檢測(cè)可能涉及的樣本類(lèi)型包括痰液�、肺泡灌洗液�����、組織等���。臨床樣本的采集建議按照國(guó)家衛(wèi)健委發(fā)布的相關(guān)實(shí)驗(yàn)室檢測(cè)技術(shù)方案執(zhí)行����。
如申報(bào)產(chǎn)品適用于不同的樣本類(lèi)型,應(yīng)針對(duì)不同樣本類(lèi)型分別進(jìn)行臨床性能評(píng)價(jià)�,包括分別進(jìn)行樣本量的估算等。
建議以與對(duì)比方法的比較研究為基礎(chǔ)進(jìn)行樣本量估算�����。臨床試驗(yàn)陽(yáng)性樣本和陰性樣本數(shù)量應(yīng)分別滿(mǎn)足統(tǒng)計(jì)學(xué)要求�����。針對(duì)與Sanger測(cè)序法或同類(lèi)已上市產(chǎn)品的對(duì)比試驗(yàn)�����,可采用目標(biāo)值法公式分別估算最低陽(yáng)性和陰性樣本例數(shù)���。
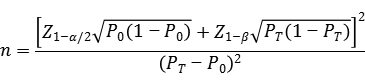
公式中�����,n為樣本量;Z1-α/2��、Z1-β為顯著性水平和把握度的標(biāo)準(zhǔn)正態(tài)分布的分?jǐn)?shù)位�����,P0為評(píng)價(jià)指標(biāo)的臨床可接受標(biāo)準(zhǔn)��,PT為申報(bào)產(chǎn)品評(píng)價(jià)指標(biāo)預(yù)期值�����。
其中陽(yáng)性符合率和陰性符合率的臨床可接受標(biāo)準(zhǔn)(P0)建議不低于90%����。臨床試驗(yàn)結(jié)果中�����,相關(guān)評(píng)價(jià)指標(biāo)的95%置信區(qū)間下限應(yīng)不低于預(yù)設(shè)的臨床可接受標(biāo)準(zhǔn)���。當(dāng)評(píng)價(jià)指標(biāo)P接近100%時(shí)�����,上述樣本量估算方法可能不適用���,應(yīng)考慮選擇更加適宜的方法進(jìn)行樣本量估算和統(tǒng)計(jì)學(xué)分析�����,如精確概率法等�。
對(duì)人類(lèi)致病的曲霉最常見(jiàn)的是煙曲霉菌���、其次是黃曲霉菌�����、黑曲霉菌���、土曲霉菌和構(gòu)巢曲霉菌等,針對(duì)曲霉菌屬通用型核酸檢測(cè)試劑���,臨床試驗(yàn)入組病例應(yīng)至少能夠涵蓋臨床常見(jiàn)的曲霉菌種:煙曲霉菌�����、黃曲霉菌�����、黑曲霉菌��。
曲霉菌為具有細(xì)胞壁的真菌��,核酸提取試劑的性能直接影響產(chǎn)品的檢測(cè)性能�����。如申報(bào)產(chǎn)品配套多個(gè)核酸提取試劑��,臨床試驗(yàn)應(yīng)以一種核酸提取試劑為主開(kāi)展臨床試驗(yàn)����,其余配套核酸提取試劑應(yīng)在不少于兩家臨床試驗(yàn)機(jī)構(gòu)��,選擇不低于200例病例進(jìn)行臨床研究����。入組病例中陰陽(yáng)性病例的分配應(yīng)能夠滿(mǎn)足評(píng)價(jià)產(chǎn)品性能要求。
6.臨床試驗(yàn)結(jié)果的統(tǒng)計(jì)分析
臨床試驗(yàn)結(jié)果一般以四格表的形式進(jìn)行總結(jié)����,并據(jù)此計(jì)算試驗(yàn)體外診斷試劑的靈敏度和特異度�,或與對(duì)比方法的陽(yáng)性/陰性符合率及其95%置信區(qū)間���。
臨床試驗(yàn)報(bào)告中應(yīng)對(duì)入組受試者的基本情況進(jìn)行分析�,包括受試者年齡�、性別的分布情況,以及臨床診斷背景等����。特別應(yīng)針對(duì)用于特異性評(píng)價(jià)的各類(lèi)受試者進(jìn)行歸類(lèi)匯總,確認(rèn)入組樣本具有較好的代表性����。臨床試驗(yàn)中如涉及不同樣本類(lèi)型,應(yīng)針對(duì)每種樣本類(lèi)型分別進(jìn)行統(tǒng)計(jì)分析���。
曲霉菌屬通用型核酸檢測(cè)試劑���,應(yīng)對(duì)每種曲霉檢測(cè)的臨床性能進(jìn)行分層分析,不同曲霉間產(chǎn)品性能應(yīng)不存在顯著差異�����。
臨床試驗(yàn)中所有不一致結(jié)果均應(yīng)結(jié)合患者的流行病學(xué)背景、臨床癥狀�����、臨床診斷以及疾病治療����、轉(zhuǎn)歸等信息進(jìn)行充分的分析。臨床試驗(yàn)結(jié)果應(yīng)能夠證明產(chǎn)品臨床性能滿(mǎn)足臨床要求��。
7.境外臨床試驗(yàn)數(shù)據(jù)的認(rèn)可
境外臨床試驗(yàn)數(shù)據(jù)應(yīng)符合《接受醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)技術(shù)指導(dǎo)原則》和《使用體外診斷試劑境外臨床試驗(yàn)數(shù)據(jù)的注冊(cè)審查指導(dǎo)原則》的相關(guān)要求�����。提交完整的臨床試驗(yàn)方案�����、報(bào)告和倫理審查意見(jiàn)�,以及該數(shù)據(jù)適用于中國(guó)患者人群的論證資料����、境內(nèi)外臨床試驗(yàn)質(zhì)量管理差異的對(duì)比資料和臨床試驗(yàn)質(zhì)量管理差異對(duì)于臨床試驗(yàn)結(jié)果影響的論證資料。
注冊(cè)申請(qǐng)人應(yīng)根據(jù)上述臨床試驗(yàn)技術(shù)審評(píng)要求�,論證境外臨床試驗(yàn)數(shù)據(jù)的充分性���。
申請(qǐng)人應(yīng)按照《體外診斷試劑注冊(cè)與備案管理辦法》、《關(guān)于公布體外診斷試劑注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》等法規(guī)文件要求提交各機(jī)構(gòu)倫理審查意見(jiàn)�����、臨床試驗(yàn)方案�����、臨床試驗(yàn)小結(jié)���、臨床試驗(yàn)報(bào)告以及臨床試驗(yàn)數(shù)據(jù)庫(kù)�。
臨床試驗(yàn)數(shù)據(jù)匯總表中應(yīng)提供病例的臨床診斷結(jié)果及支持病例臨床診斷結(jié)果的臨床特征���、影像學(xué)表現(xiàn)����、微生物學(xué)證據(jù)等信息���。
該類(lèi)產(chǎn)品樣本處理及核酸提取試劑會(huì)影響產(chǎn)品檢測(cè)性能����,臨床試驗(yàn)在選擇已上市同類(lèi)產(chǎn)品進(jìn)行臨床試驗(yàn)時(shí),特別注意�,對(duì)比試劑配套使用的核酸提取試劑應(yīng)滿(mǎn)足其說(shuō)明書(shū)要求。
(五)產(chǎn)品說(shuō)明書(shū)和標(biāo)簽樣稿
產(chǎn)品說(shuō)明書(shū)格式應(yīng)滿(mǎn)足《體外診斷試劑說(shuō)明書(shū)編寫(xiě)指導(dǎo)原則》的要求���。產(chǎn)品說(shuō)明書(shū)中技術(shù)內(nèi)容應(yīng)與注冊(cè)申報(bào)資料中的相關(guān)研究結(jié)果保持一致�����,如某些內(nèi)容引用自參考文獻(xiàn)���,應(yīng)以規(guī)范格式進(jìn)行標(biāo)注,并單獨(dú)列明文獻(xiàn)的相關(guān)信息����。曲霉核酸檢測(cè)試劑說(shuō)明書(shū)編寫(xiě)應(yīng)重點(diǎn)關(guān)注以下內(nèi)容。
1.1本試劑盒用于體外定性檢測(cè)需要進(jìn)行xxx病診斷或鑒別診斷者的xxx樣本(具體描述樣本類(lèi)型)中的曲霉菌屬(或某一曲霉菌種)DNA�����。
1.2臨床上易發(fā)生曲霉感染的人群如:粒細(xì)胞缺乏�、血液系統(tǒng)惡性腫瘤�����、器官移植、遺傳或獲得性免疫缺陷��、慢性阻塞性肺部疾病�、糖尿病等人群。
1.3簡(jiǎn)單介紹曲霉病原學(xué)特征����、流行病學(xué)特征以及臨床表現(xiàn)和現(xiàn)有診斷方法等。
1.4強(qiáng)調(diào)本試劑盒檢測(cè)結(jié)果僅供臨床參考�,不得作為臨床診斷的唯一標(biāo)準(zhǔn)。建議結(jié)合患者臨床表現(xiàn)和其他實(shí)驗(yàn)室檢測(cè)對(duì)病情進(jìn)行綜合分析�����。
簡(jiǎn)述產(chǎn)品的核酸提取和PCR原理�。明確內(nèi)標(biāo)基因名稱(chēng)及其作用。如采用了防污染措施�����,進(jìn)行簡(jiǎn)要描述�����。
明確試劑盒中各組分及具體成分�����。明確需要但未提供的材料,例如核酸提取試劑��,樣本保存液����,樣本消化液等的產(chǎn)品名稱(chēng),生產(chǎn)廠家����,貨號(hào)及注冊(cè)證號(hào)、備案號(hào)等信息��。
需詳細(xì)描述樣本采集���、保存��、運(yùn)輸和處理方式���,包括采樣步驟��,采樣量��,保存液、消化液的使用體積�,滅活方式等。描述樣本及核酸提取液的保存穩(wěn)定性�。
明確核酸提取用的樣本體積、洗脫體積和PCR加樣體積�,陰、陽(yáng)性質(zhì)控品與待測(cè)樣本同步進(jìn)行核酸提取操作��。明確各適用機(jī)型的反應(yīng)參數(shù)設(shè)置�。明確質(zhì)控品和內(nèi)標(biāo)的檢測(cè)結(jié)果Ct值范圍,作為試驗(yàn)有效性的標(biāo)準(zhǔn)�。
簡(jiǎn)述陽(yáng)性判斷值確定的方法,包括研究人群特征���、研究樣本量和統(tǒng)計(jì)分析方法等����。
通過(guò)擴(kuò)增曲線(xiàn)和Ct值進(jìn)行結(jié)果陰陽(yáng)性的判斷��,列明結(jié)果陰性��、陽(yáng)性�����、復(fù)測(cè)、無(wú)效等所有情形��。
8.1本試劑盒的檢測(cè)結(jié)果僅供臨床參考��,對(duì)患者的臨床診治應(yīng)結(jié)合其癥狀/體征����、病史、其他實(shí)驗(yàn)室檢查及治療反應(yīng)等情況綜合考慮�����。
8.2有關(guān)假陽(yáng)性結(jié)果的可能性分析
8.2.1如果樣本在運(yùn)輸����、處理過(guò)程中發(fā)生交叉污染,則可能導(dǎo)致假陽(yáng)性結(jié)果����;
8.2.2試驗(yàn)環(huán)境有PCR產(chǎn)物等氣溶膠污染,則可能導(dǎo)致假陽(yáng)性結(jié)果�;
8.2.3試驗(yàn)過(guò)程中使用的耗材、設(shè)備等受污染���,則可能導(dǎo)致假陽(yáng)性結(jié)果�����。
8.3有關(guān)假陰性結(jié)果的可能性分析
8.3.1不合理的樣本采集�����、轉(zhuǎn)運(yùn)��、儲(chǔ)存及處理��、樣本中病原體含量過(guò)低均有可能導(dǎo)致假陰性結(jié)果�;
8.3.2該病原體待測(cè)靶序列的變異或其他原因?qū)е碌男蛄懈淖兛赡軙?huì)導(dǎo)致假陰性結(jié)果�����;
8.3.3未經(jīng)驗(yàn)證的其他干擾或PCR抑制因子等可能會(huì)導(dǎo)致假陰性結(jié)果�����。
8.4本試劑盒不能區(qū)分真菌污染����、定植和感染����,應(yīng)結(jié)合臨床癥狀和其他檢查結(jié)果綜合判斷��。
簡(jiǎn)述試劑性能指標(biāo)和研究情況����,建議包含:參考品的符合性、準(zhǔn)確性���、檢出限����、包容性�、精密度、分析特異性�、臨床試驗(yàn)等。
10.1試劑保存運(yùn)輸及使用過(guò)程中多種因素可能導(dǎo)致性能變化����,如保存運(yùn)輸不當(dāng)、樣本采集�����、樣本處理及檢測(cè)過(guò)程操作不規(guī)范等,請(qǐng)嚴(yán)格按照說(shuō)明書(shū)操作���。
10.2生物安全防護(hù)相關(guān)內(nèi)容
[1]?國(guó)家藥品監(jiān)督管理局. 關(guān)于公布體外診斷試劑注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告: 國(guó)家藥品監(jiān)督管理局公告2021年第122號(hào)[Z].
[2] 原國(guó)家食品藥品監(jiān)督管理總局.體外診斷試劑說(shuō)明書(shū)編寫(xiě)指導(dǎo)原則: 國(guó)家食品藥品監(jiān)督管理總局公告2014年第17號(hào)[Z].
[3]?國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心.定性檢測(cè)試劑分析性能評(píng)估注冊(cè)審查指導(dǎo)原則: 國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心公告2022年第36號(hào)[Z].
[4] 國(guó)家藥品監(jiān)督管理局 國(guó)家衛(wèi)生健康委員會(huì).?醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范:國(guó)家藥監(jiān)局 國(guó)家衛(wèi)生健康委關(guān)于發(fā)布醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范的公告2022年第28號(hào)[Z].
[5] 原國(guó)家食品藥品監(jiān)督管理總局.?接受醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)技術(shù)指導(dǎo)原則:食品藥品監(jiān)管總局關(guān)于發(fā)布接受醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)技術(shù)指導(dǎo)原則的通告2018年第13號(hào)[Z].
[6]?國(guó)家藥品監(jiān)督管理局. 體外診斷試劑臨床試驗(yàn)技術(shù)指導(dǎo)原則: 國(guó)家藥品監(jiān)督管理局通告2021年第72號(hào)[Z].
[7]?國(guó)家藥品監(jiān)督管理局. 使用體外診斷試劑境外臨床試驗(yàn)數(shù)據(jù)的注冊(cè)審查指導(dǎo)原則: 國(guó)家藥品監(jiān)督管理局通告2021年第95號(hào)[Z].?




