受理號:CQZ2101027
醫(yī)療器械產(chǎn)品注冊技術(shù)審評報告?
產(chǎn)品中文名稱:左心耳封堵器系統(tǒng)?
申請人名稱:杭州德諾電生理醫(yī)療科技有限公司?
國家藥品監(jiān)督管理局?
醫(yī)療器械技術(shù)審評中心
基本信息?
一���、申請人名稱 杭州德諾電生理醫(yī)療科技有限公司?
二��、申請人住所 浙江省杭州市臨平區(qū)東湖街道龍船塢路96號3幢1樓127 室?
三���、生產(chǎn)地址 浙江省杭州市濱江區(qū)西興街道江陵路88號2幢3樓316室、 1樓105室
技術(shù)審評概述?
(一)產(chǎn)品結(jié)構(gòu)及組成?
左心耳封堵器系統(tǒng)由左心耳封堵器和輸送器組成���,其中左 心耳封堵器由密封盤和錨定盤連接而成����。輸送器由輸送鞘管����、 擴張器、裝載器�����、輸送鋼纜和止血閥組成�。產(chǎn)品經(jīng)環(huán)氧乙烷滅 菌����,一次性使用。?
左心耳封堵器系統(tǒng)適用于有卒中風險(CHA2DS2-VASc評 分≥2分)����,且長期口服抗凝治療禁忌的非瓣膜性房顫患者。?
表1 左心耳封堵器型號規(guī)格表
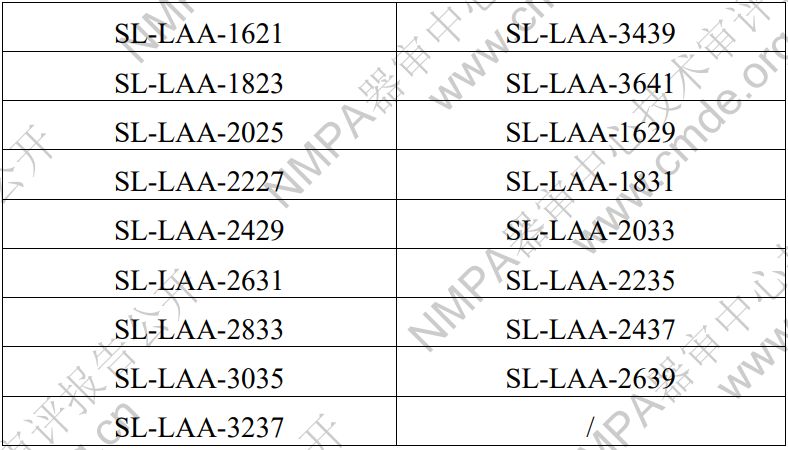
表2 輸送器型號規(guī)格表
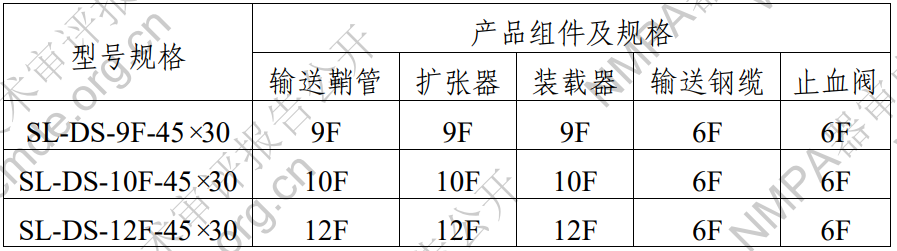
左心耳封堵器主體采用鎳鈦合金材料制作而成�,通過輸送 器輸送到左心耳位置后會自行膨脹,錨定盤與左心耳壁貼附�, 通過自身的徑向支撐力及錨定倒鉤將左心耳封堵器固定在左心 耳錨定區(qū)域�����;密封盤覆蓋在左心耳開口位置�,通過其阻流膜封 堵左心耳�����。?
1. 產(chǎn)品技術(shù)要求研究 產(chǎn)品技術(shù)要求研究項目如表3所示��。?
表3 產(chǎn)品技術(shù)要求研究項目摘要



產(chǎn)品性能評價包括模擬使用性能����、疲勞性能、MRI兼容性 研究���、有限元分析研究��、原材料金屬成分分析研究�、縫合線和 覆膜性能研究����、左心耳封堵器鎳離子體外釋放研究�、乙醇殘留 量研究�����、貨架效期研究�、射線可探測性研究等。
針對左心耳封 堵器及輸送器亦開展了相應(yīng)的性能驗證��。?
該產(chǎn)品包含左心耳封堵器和輸送器兩部分���,其中左心耳封 堵器為植入器械��,與循環(huán)血液長期接觸���;輸送器為外部接入器 械,與循環(huán)血液短期接觸����。申請人按照 GB/T 16886系列標準對 植入器械及外部接入器械分別進行了生物相容性評價�,產(chǎn)品的 生物相容性風險可接受,具體評價項目詳見表4��。?
表4 生物相容性評價表

該產(chǎn)品采用環(huán)氧乙烷滅菌���,無菌狀態(tài)提供��。申請人提供了 滅菌確認報告�,證明無菌保證水平可達10-6。針對環(huán)氧乙烷殘 留量開展了研究��。?
(四)產(chǎn)品有效期和包裝 該產(chǎn)品貨架有效期為三年���。
申請人提供了貨架有效期驗證 報告����,包括產(chǎn)品穩(wěn)定性�、包裝完整性和模擬運輸驗證報告等。?
申請人開展了犬模型的動物試驗研究�,通過器械操作、大 體解剖觀察����、組織切片觀察、超聲檢查����、造影檢查等評價器械 可操作性和封堵器植入后的安全性。動物試驗結(jié)果表明�,產(chǎn)品 達到預(yù)期設(shè)計要求�����。
申報產(chǎn)品通過臨床試驗路徑開展臨床評價。臨床試驗為前 瞻性���、多中心����、單組目標值法設(shè)計�����,預(yù)計入組受試者163例�。?
1. 主要評價指標 術(shù)后6個月左心耳關(guān)閉率(封堵器植入后,經(jīng)超聲證實沒 有前向或逆向的血流穿過封堵器����,封堵器邊緣殘余前向或逆向 血流≤3mm��,殘余分流≥3級)�。
- 器械成功率(順利輸送左心耳封堵器至左心耳���,成功釋 放左心耳封堵器,順利撤出輸送系統(tǒng))����;?
- 技術(shù)成功率(封堵器植入成功,且殘余分流<5mm��,并無 主要不良事件出現(xiàn))�����;?
- 12個月內(nèi)的缺血性腦卒中率(事件/病人年)���;?
- 缺血性腦卒中是指由短暫性腦缺血發(fā)作���、腦血栓形成或 腦栓塞等原因引起的腦部本身病變和(或)全身血液循環(huán)紊亂 導(dǎo)致腦血液供給障礙所造成的神經(jīng)功能缺失。缺血性腦卒中定 義為卒中發(fā)生后90天的修正Rankin分數(shù)(mRS)≥2���;?
- 術(shù)后7天內(nèi)主要不良事件(MAE)發(fā)生率���;MAE定義:不明原因的死亡或任何器械或手術(shù)相關(guān)的并發(fā)癥,包括但不局限于:死亡,需要心包穿刺或手術(shù)的嚴重心包 填塞�,器械栓塞,手術(shù)相關(guān)的中風�。?
- 術(shù)后45天、6個月���、12個月器械或手術(shù)相關(guān)的嚴重不良事 件發(fā)生率����;?
- 術(shù)后 45天����、6個月、12個月不良事件發(fā)生率��;?
- 術(shù)后45天���、6個月�����、12個月卒中率��;?
- 封堵器性能:采用多普勒超聲心動圖�,評價術(shù)后7天內(nèi)或 出院前(以先到時間點為準)、術(shù)后45天�、6個月和12個月的 器械性能(包括移位����、脫落、返流�、器械相關(guān)的血栓形成)。?
臨床試驗結(jié)果顯示��,168例患者中有163例納入全分析集 (FAS)���,152例納入符合方案分析集(PPS)����。?
在FAS集����,受試者術(shù)后6個月左心耳關(guān)閉率為96.32%,95% 可信區(qū)間為(92.16%-98.64%)�����;在PPS集�,152例受試者術(shù)后6 個月左心耳關(guān)閉率為100.00%,95%可信區(qū)間為(97.6%-100%)?
器械成功率為100.00%;技術(shù)成功率為99.39%�;12個月內(nèi) 的缺血性腦卒中率為1.23%;術(shù)后45天�、6月和12月卒中率分別為0.61%、0.61%和2.45%��;術(shù)后7天���、45天�、6個月及12個月器 械相關(guān)的血栓發(fā)生率分別為0.00%��、0.66%��、2.04%和0.00%����;術(shù)后7天、45天�����、6個月及12個月返流發(fā)生率分別為0.00%���、 0.70%�����、0.00%和2.00%���;術(shù)后7天、45天�、6個月及12個月移位 和脫落發(fā)生率均為0.00%。術(shù)后7天內(nèi)主要不良事件(MAE) 發(fā)生率為0.61%��;術(shù)后12個月不良事件:共發(fā)生120(73.62%) 例不良事件��,共370例次不良事件����,與試驗器械相關(guān)的不良事 件為15例;術(shù)后12個月嚴重不良事件:共發(fā)生26(15.95%)例 嚴重不良事件�,共28例次嚴重不良事件,與試驗器械相關(guān)的不 良事件4例���。?
申請人后續(xù)補充分析了12個月左心耳關(guān)閉率��,其中��,F(xiàn)AS 集161例�,PPS集151例,F(xiàn)AS集術(shù)后12個月左心耳關(guān)閉率為 98.77%��,95%可信區(qū)間為(95.64%-99.85%)�;PPS集術(shù)后12個 月 左 心 耳 關(guān) 閉 率 為 99.34% , 95% 可 信 區(qū) 間 為 ( 96.39%- 99.98%)�����。
受益:左心耳封堵器系統(tǒng)適用于有卒中風險(CHA2DS2- VASc 評分≥2 分)���,且長期口服抗凝治療禁忌的非瓣膜性房顫 患者。
風險:該產(chǎn)品臨床使用可能為適用人群帶來的主要風險為:心包積液����、心包填塞、器械相關(guān)血栓形成�、空氣栓塞、器械脫 落等��。根據(jù)申請人提供的申報資料�,經(jīng)綜合評價,在目前認知 水平上����,認為該產(chǎn)品的上市為適用人群帶來的受益大于風險���。?
為保證用械安全,基于對主要剩余風險的規(guī)避���,需在說明書中 提示以下信息:?
左心耳封堵器系統(tǒng)適用于有卒中風險(CHA2DS2-VASc 評 分≥2 分)�����,且長期口服抗凝治療禁忌的非瓣膜性房顫患者。?
1. 本器械只能由經(jīng)過介入操作培訓(xùn)的醫(yī)生使用���,由醫(yī)生嚴 格按照適應(yīng)癥選擇病人���。本公司不負責任何由于未經(jīng)培訓(xùn)的人 員使用而造成的直接的或因此引起的損傷和費用。?
2. 潛在的器械栓塞會存在����,手術(shù)醫(yī)生需要為這種情況做出 取出栓塞器械的準備。?
3. 如果在手術(shù)的任何階段遇到阻力����,停止手術(shù)�����,只有明確 產(chǎn)生阻力的原因后才可繼續(xù)手術(shù)��。?
4. 對鎳鈦有過敏反應(yīng)的患者可能因左心耳封堵器的植入而 發(fā)生過敏反應(yīng)���。
6. 本器械在出廠時進行了一次環(huán)氧乙烷滅菌,不得重新滅 菌或重復(fù)使用����,本器械為一次性使用。重新滅菌可能會滅菌不 充分��,也可能會導(dǎo)致故障損傷病人�。?
7. 本器械必須在有效期內(nèi)使用,使用前應(yīng)詳細閱讀說明 書�����。使用前應(yīng)仔細檢查器械各個組件�,若出現(xiàn)受損等異常現(xiàn) 象�,應(yīng)立即停止使用��。?
8. 器械在進入人體之前應(yīng)檢查輸送鋼纜與封堵器的螺紋配 合情況��,螺紋配合圈數(shù)應(yīng)大于等于 4 圈�,若少于 4 圈則應(yīng)更換 器械���。?
9. 若封堵器進入輸送鞘管中的推送力過大或無法推進��,術(shù)者應(yīng)更換封堵器或輸送器����。?
10. 回收次數(shù)不超過五次��。如仍無法達到合適效果�,則需 更換新器械����。
11. 左心耳是薄壁結(jié)構(gòu)。在接近左心耳以及放置封堵器時 應(yīng)小心謹慎��。?
12. 術(shù)中左心耳封堵器系統(tǒng)需充分排氣����,直到系統(tǒng)中沒有 空氣為止�。
13. 房間隔穿刺后����,在整個手術(shù)期間對患者進行充分肝素 化治療,維持激活凝血時間 (ACT)?250?s 以上����。?
14. 植入封堵器時應(yīng)在 X 線透視和超聲心動圖引導(dǎo)下進 行。?
15. 封堵器的選擇應(yīng)基于使用 X 線透視和超聲心動圖引導(dǎo) (推薦 TEE)在多個角度 (即 0°��、45°���、90°����、135°)獲得的準 確的 LAA?測量值��。?
16. 左心耳封堵器在植入過程中要評估其錨定位置��,避免 對回旋支造成影響����。?
17. 左心耳封堵器在釋放前要充分牽拉以評估其錨定穩(wěn)定性。?
18. 術(shù)后應(yīng)進行適當?shù)乃幬镏委煟斠姟昂筇幚怼辈糠帧?
1. 本器械儲存在常溫����、干燥的室內(nèi),保持環(huán)境清潔�����、通風 良好�、無腐蝕性氣體。?
4. 本器械運輸時,嚴禁擠壓����、淋濕暴曬���,搬運時小心輕 放�����。
5. 本器械使用前發(fā)現(xiàn)任何疑問�����,可直接與代理商或生產(chǎn)廠 家取得聯(lián)系�。?
6. 左心耳封堵器的MRI相容性:左心耳封堵器經(jīng)過非臨床 測試,在以下的條件進行MRI檢查是安全的:- 靜磁場小于等于3T���。- 磁場梯度空間為小于等于720G/cm����。- 在最大全身特定平均吸收率(SAR)3W/KG下掃描15分 鐘���。?
7. 醫(yī)生應(yīng)依據(jù)臨床狀況來判斷�,在本器械使用前�����、中和后 抗凝劑或抗血小板藥的使用��。?
8. 如果病人已經(jīng)植入了除顫器(ICD)和探頭�,醫(yī)生應(yīng)非 常謹慎。?
9. 確信血管的大小對于選擇的輸送鞘管是充分的���。?
10. 如果植入左心耳封堵器后�����,在該植入點或附近進行消 融手術(shù)時���,醫(yī)生應(yīng)該非常謹慎���。?
11. 應(yīng)該通過標準的介入心血管導(dǎo)管技術(shù)來使用本器械。?
左心耳封堵器系統(tǒng)禁止用于但不限于以下情況:?
1. 不適合本器械規(guī)格規(guī)定的病人���。?
3. 病人存在心內(nèi)膜炎癥或傳染病產(chǎn)生的病菌�。?
4. 對X射線有禁忌或不適合TEE(經(jīng)食道超聲)檢查的病 人。?
7. 左心耳的解剖結(jié)構(gòu)不適合植入封堵器的病人�。?
8. 病人已經(jīng)在心血管腔內(nèi)放置了其他器械,會干涉放置該 器械的��。
綜合評價意見?
本申報產(chǎn)品屬于創(chuàng)新醫(yī)療器械(創(chuàng)新編號:CQTS1600175)�。申請人的注冊申報資料符合現(xiàn)行要求,依據(jù) 《醫(yī)療器械監(jiān)督管理條例》(國務(wù)院令第 739 號)���、《醫(yī)療器 械注冊管理辦法》(國家食品藥品監(jiān)督管理總局令第 4 號)等 相關(guān)醫(yī)療器械法規(guī)與配套規(guī)章��,經(jīng)系統(tǒng)評價后�,建議準予注冊�。?
2022 年 11 月 4 日
