受理號(hào):CQZ2101008
醫(yī)療器械產(chǎn)品注冊(cè)技術(shù)審評(píng)報(bào)告?
產(chǎn)品中文名稱:優(yōu)美莫司涂層冠狀動(dòng)脈球囊擴(kuò)張導(dǎo)管?
申請(qǐng)人名稱 :山東吉威醫(yī)療制品有限公司 國家藥品監(jiān)督管理局 醫(yī)療器械技術(shù)審評(píng)中心
基本信息?
一�、申請(qǐng)人名稱 山東吉威醫(yī)療制品有限公司?
二�����、申請(qǐng)人住所 威海市高區(qū)大連路 68 號(hào)?
三����、生產(chǎn)地址 威海市大連路 68-2 號(hào)
技術(shù)審評(píng)概述?
(一)產(chǎn)品結(jié)構(gòu)及組成?
該產(chǎn)品由球囊擴(kuò)張導(dǎo)管及球囊上的藥物涂層組成���,球囊導(dǎo) 管由球囊����、遠(yuǎn)端管���、過渡管和近端管等組成����。藥物涂層含有優(yōu) 美莫司和聚環(huán)氧乙烷載體��,藥物劑量為 3μg/mm2�。產(chǎn)品經(jīng)環(huán)氧 乙烷滅菌��,一次性使用����。貨架有效期 2 年�。?
用于血管直徑 2.0mm-2.75mm 原發(fā)冠狀動(dòng)脈血管病變治療。?
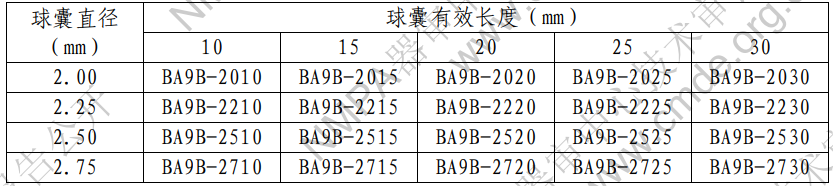
產(chǎn)品的型號(hào)規(guī)格見表 1�����。?
表 1 型號(hào)規(guī)格表
將產(chǎn)品輸送至小血管病變位置�����,通過球囊充壓擴(kuò)張血管狹窄部 位�。由于血管成形術(shù)后易因血管內(nèi)膜過度增生等因素導(dǎo)致再狹窄,涂覆于球囊上的 BA9 在球囊擴(kuò)張時(shí)轉(zhuǎn)移至靶血管組織并起到抑制血管內(nèi)膜增生的效果��。?
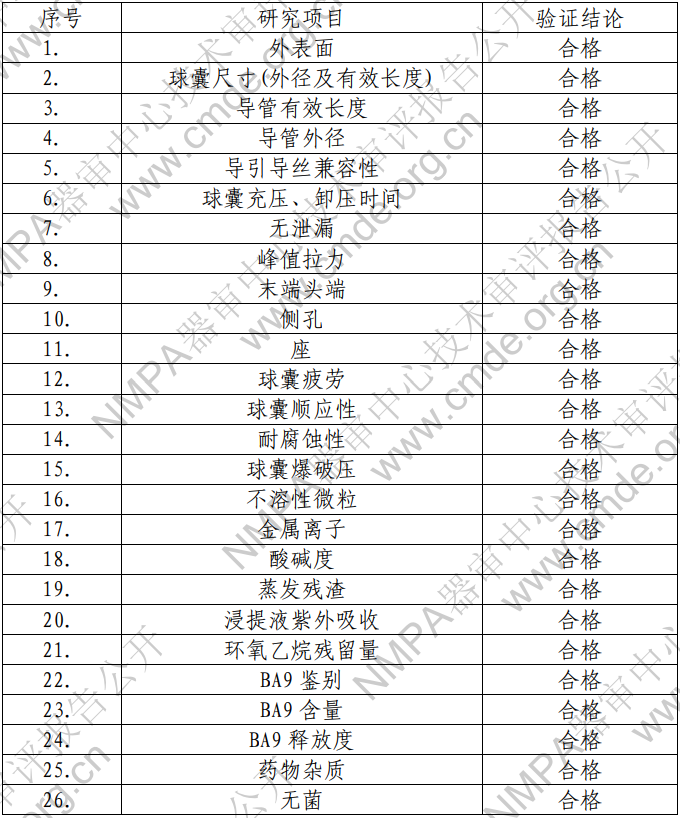
產(chǎn)品技術(shù)要求研究項(xiàng)目如表 2 所示:?
表 2 產(chǎn)品技術(shù)要求研究摘要

2. 產(chǎn)品性能評(píng)價(jià)?
產(chǎn)品性能評(píng)價(jià)包括 YY0285.1-2017、YY0285.4-2017�����、《球囊 擴(kuò)張導(dǎo)管注冊(cè)技術(shù)審查指導(dǎo)原則》中的研究項(xiàng)目,針對(duì)藥物涂 層�����,研究了藥物涂層釋放性能���、涂層完整性�����、載體穩(wěn)定性�、模 擬使用后微粒釋放研究����、涂層牢固度、涂層均勻性��、球囊再折 疊形態(tài)���、溶劑殘留����、藥物含量確定依據(jù)及測(cè)定方法��、涂層劑量 選擇、雜質(zhì)鑒別���、模擬使用等項(xiàng)目����。?
依據(jù) GB/T 16886 系列標(biāo)準(zhǔn)�,開展了生物相容性評(píng)價(jià)。進(jìn)行 了細(xì)胞毒性�、皮膚致敏試驗(yàn)、皮內(nèi)反應(yīng)��、急性全身毒性����、溶血、 凝血(PTT)����、體內(nèi)血栓形成、植入��、遺傳毒性���、生殖毒性等項(xiàng) 目的評(píng)價(jià)�����。針對(duì)藥物及載體與人體長期接觸的風(fēng)險(xiǎn)�����,提交了產(chǎn) 品的可瀝濾物分析報(bào)告和毒理學(xué)風(fēng)險(xiǎn)評(píng)價(jià)報(bào)告�、藥物的安全性 資料����、載體聚環(huán)氧乙烷代謝情況的支持性資料。申請(qǐng)人還提交 了含有聚環(huán)氧乙烷和 BA9 藥物的支架產(chǎn)品上市使用情況��。產(chǎn)品 生物相容性風(fēng)險(xiǎn)可接受��。
提交了產(chǎn)品的滅菌確認(rèn)報(bào)告��,產(chǎn)品采用環(huán)氧乙烷滅菌��,無 菌保證水平為 10-6�,提供了滅菌微生物和物理性能鑒定報(bào)告。提 交了環(huán)氧乙烷殘留量和 2-氯乙醇?xì)埩袅繙y(cè)試報(bào)告�。?
該產(chǎn)品有效期為兩年。申請(qǐng)人提供了貨架有效期實(shí)時(shí)老化 驗(yàn)證報(bào)告。包括產(chǎn)品穩(wěn)定性���、包裝完整性和模擬運(yùn)輸驗(yàn)證����。?
申請(qǐng)人采用豬模型分別開展了體內(nèi)使用性能����、安全性、體 內(nèi)藥代動(dòng)力學(xué)及組織分布的動(dòng)物試驗(yàn)研究�����。?
申請(qǐng)人通過臨床試驗(yàn)路徑開展臨床評(píng)價(jià),臨床試驗(yàn)采用前 瞻性�、多中心、隨機(jī)�、盲法、平行對(duì)照��、優(yōu)效性設(shè)計(jì)�,臨床試 驗(yàn)共入組 206 例受試者,其中試驗(yàn)組 105 例,對(duì)照組 101 例�。對(duì)照組受試者接受普通球囊擴(kuò)張導(dǎo)管(Powerline)治療����。?
臨床試驗(yàn)的主要評(píng)價(jià)指標(biāo)為 9 個(gè)月病變節(jié)段內(nèi)晚期管腔丟 失(病變水平以及受試者水平)。次要評(píng)價(jià)指標(biāo)為介入治療成 功率(包括器械成功�、病變成功及臨床成功);術(shù)后 9 個(gè)月的 再狹窄率����;術(shù)后、術(shù)后 30 天�、6 個(gè)月、9 個(gè)月�、12 個(gè)月時(shí)器械 相關(guān)的心血管臨床復(fù)合終點(diǎn),即靶病變失?���。═LF),包括心源 性死亡��、靶血管心肌梗死及臨床癥狀驅(qū)動(dòng)的靶病變血運(yùn)重建(CD-TLR)���。安全性評(píng)價(jià)內(nèi)容包括術(shù)后�、術(shù)后 30 天、6 個(gè)月��、9 個(gè)月�����、12 個(gè)月主要不良心血管事件發(fā)生率(受試者包括心源性 死亡或全因死亡���、所有心肌梗死�����、靶病變/靶血管血允重建�����、重 復(fù)介入治療或冠狀動(dòng)脈旁路植入的復(fù)合終點(diǎn))���、病變擴(kuò)張?zhí)幯?栓發(fā)生率(受試者包括早期、晚期及極晚期時(shí)間范圍內(nèi)��,確定 的����、可能的病變擴(kuò)張?zhí)幯ǎ?����、不良事件�、器械缺陷?
臨床試驗(yàn)結(jié)果顯示:在 FAS 集��,主要評(píng)價(jià)指標(biāo) 9 個(gè)月病變 節(jié)段內(nèi)晚期管腔丟失(病變水平)試驗(yàn)組為 0.17±0.32mm�,對(duì) 照組為 0.29±0.35mm�,差異有統(tǒng)計(jì)學(xué)意義(P=0.0034);試驗(yàn) 組與對(duì)照組的組間差值為-0.11mm�����,95%置信區(qū)間為(-0.2111����, -0.0189)mm。主要評(píng)價(jià)指標(biāo) 9 個(gè)月病變節(jié)段內(nèi)晚期管腔丟失(受 試者水平)試驗(yàn)組為 0.17±0.32mm���,對(duì)照組為 0.29±0.35mm����, 差異有統(tǒng)計(jì)學(xué)意義(P=0.0043)���,試驗(yàn)組與對(duì)照組的組間差值 為-0.12mm��,95%置信區(qū)間為(-0.2141����,-0.0165)mm 。在 PPS 集�,主要評(píng)價(jià)指標(biāo) 9 個(gè)月病變節(jié)段內(nèi)晚期管腔丟失(病變水平) 試驗(yàn)組為 0.16±0.29mm,對(duì)照組為 0.30±0.35mm���,差異有統(tǒng)計(jì) 學(xué)意義(P=0.0010)����。試驗(yàn)組與對(duì)照組的組間差值為-0.14mm�, 95%置信區(qū)間為(-0.2361,-0.0486)mm�����。主要評(píng)價(jià)指標(biāo) 9 個(gè)月 病變節(jié)段內(nèi)晚期管腔丟失(受試者水平)試驗(yàn)組為 0.16± 0.29mm �����, 對(duì) 照 組 為 0.30 ± 0.35mm ��,差異有統(tǒng)計(jì)學(xué)意義 (P=0.0011),試驗(yàn)組與對(duì)照組的組間差值為-0.14mm�,95%置 信區(qū)間為(-0.2389,-0.0472)mm����。?
次要評(píng)價(jià)指標(biāo)結(jié)果顯示:1.在 FAS 集,試驗(yàn)組介入成功率 為 94.29%����,對(duì)照組為 92.08%���。在 PPS 集���,試驗(yàn)組介入成功率結(jié)果為 94.38%,對(duì)照組為 90.91%��。組間比較結(jié)果均顯示差異無統(tǒng) 計(jì)意義��。2.在 FAS 集���,試驗(yàn)組術(shù)后 9 個(gè)月再狹窄率為 7.45%����,對(duì) 照組為 12.50%。在 PPS 集�,試驗(yàn)組術(shù)后 9 個(gè)月再狹窄率為 7.69%, 對(duì)照組為 11.96% �。組間比較結(jié)果均顯示差異無統(tǒng)計(jì)意義。3. 在 FAS 集���,試驗(yàn)組靶病變失敗率在術(shù)后至出院前�、術(shù)后 30 天���、 術(shù)后 6 個(gè)月�、術(shù)后 9 個(gè)月及術(shù)后 12 個(gè)月分別為 0.95%��、0.95%��、 0.95%���、6.67%及 6.67%����,對(duì)照組在術(shù)后至出院前����、術(shù)后 30 天�����、 術(shù)后 6 個(gè)月��、術(shù)后 9 個(gè)月及術(shù)后 12 個(gè)月的靶病變失敗率分別為 1.98%����、2.97%����、5.94%、12.87%及 13.86%���,組間比較結(jié)果顯示差 異無統(tǒng)計(jì)意義。在 PPS 集�����,試驗(yàn)組術(shù)后至出院前�、術(shù)后 30 天、 術(shù)后 6 個(gè)月���、術(shù)后 9 個(gè)月及術(shù)后 12 個(gè)月的靶病變失敗率分別為 1.12%�、1.12%、1.12%�、7.87%及 7.87%,對(duì)照組術(shù)后至出院前����、 術(shù)后 30 天、術(shù)后 6 個(gè)月���、術(shù)后 9 個(gè)月及術(shù)后 12 個(gè)月的靶病變 失敗率分別為 2.27%����、3.41%�、5.68%、13.64%及 14.77%�,組間 比較結(jié)果顯示差異無統(tǒng)計(jì)意義。
安全性評(píng)價(jià)結(jié)果顯示:試驗(yàn)組累計(jì) 15 例受試者發(fā)生主要不 良心血管事件����,其中所有心肌梗死 1 例,任何再次血運(yùn)重建 14 例��,術(shù)后至出院前��、術(shù)后 30 天、術(shù)后 6 個(gè)月�、術(shù)后 9 個(gè)月及術(shù) 后 12 個(gè)月的主要不良心血管事件發(fā)生率分別為 0.95%、0.95%�����、 1.90%�、13.33%及 14.29%,無全因死亡事件發(fā)生����。對(duì)照組累計(jì) 22 例受試發(fā)生者主要不良心血管事件,其中全因死亡 2 例��,所 有心肌梗死 4 例��,任何再次血運(yùn)重建 19 例�,術(shù)后至出院前、術(shù) 后 30 天�����、術(shù)后 6 個(gè)月����、術(shù)后 9 個(gè)月及術(shù)后 12 個(gè)月的主要不良 心血管事件發(fā)生率分別為 1.98%、3.96%���、6.93%�����、18.81%及21.78%�。主要不良心血管事件組間無統(tǒng)計(jì)學(xué)差異�。試驗(yàn)組無病 變擴(kuò)張?zhí)幯ㄐ纬桑瑢?duì)照組發(fā)生率為 1.98%����。不良事件發(fā)生率和 嚴(yán)重不良事件發(fā)生率組間無統(tǒng)計(jì)學(xué)差異。試驗(yàn)器械發(fā)生 1 例器 械缺陷���,試驗(yàn)器械無法通過血管近端至遠(yuǎn)端靶病變處�,予以更 換器械后順利至靶病變處�,完成操作。?
綜上����,臨床資料符合技術(shù)審評(píng)要求。?
四����、產(chǎn)品受益風(fēng)險(xiǎn)判定?
參照《YY/T 0316-2016 醫(yī)療器械風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的應(yīng) 用》���,對(duì)該產(chǎn)品進(jìn)行風(fēng)險(xiǎn)分析。對(duì)目前已知及可預(yù)測(cè)風(fēng)險(xiǎn)采取了 風(fēng)險(xiǎn)控制措施�����,經(jīng)綜合評(píng)價(jià)�,在目前認(rèn)知水平上,認(rèn)為該產(chǎn)品 獲益/受益大于風(fēng)險(xiǎn)���。?
·必須審慎地選擇患者,因?yàn)槭褂么祟惼餍悼赡軙?huì)導(dǎo)致亞急 性血栓形成���、血管并發(fā)癥和/或出血事件的相關(guān)風(fēng)險(xiǎn)�����。
·對(duì)優(yōu)美莫司和聚環(huán)氧乙烷過敏的患者若使用此器械可能 會(huì)出現(xiàn)過敏反應(yīng)����。? 應(yīng)由接受過相關(guān)培訓(xùn)的專業(yè)人士來完成手術(shù)的操作�����。?
·球囊擴(kuò)張壓力不應(yīng)超過最大推薦充盈壓力�。
·請(qǐng)使用前認(rèn)真核實(shí),不要使用超過有效期的產(chǎn)品�����。?
·使用本產(chǎn)品的醫(yī)院必須具備在發(fā)生潛在損傷或出現(xiàn)危及 生命的并發(fā)癥時(shí)能夠快速�、緊急處理的條件。?
·本產(chǎn)品在出廠前已經(jīng)過滅菌處理���。僅供一次性使用���,請(qǐng)勿 自行滅菌重復(fù)使用。?
·在使用前���,請(qǐng)仔細(xì)檢查包裝�����,不要使用包裝破損的產(chǎn)品����。?
·為減少球囊過度充盈的危險(xiǎn),建議采用帶壓力表(經(jīng)過校 準(zhǔn))的充盈壓力泵���。?
·在使用產(chǎn)品前����,請(qǐng)仔細(xì)閱讀產(chǎn)品說明書����。?
·本品僅為一次性使用的醫(yī)療器械,不能將其重復(fù)消毒或使 用��。注意產(chǎn)品的“失效日期”����,必須在標(biāo)注的失效日期前使 用。?
·如因物理或化學(xué)損傷造成球囊涂層磨損者����,請(qǐng)勿使用。?
·為了防止藥物球囊穿過狹窄血管時(shí)球囊上的藥物涂層脫 落����,建議使用 PTCA 球囊對(duì)病變進(jìn)行預(yù)擴(kuò)張����。?
·在進(jìn)行球囊擴(kuò)張前必須確認(rèn)選擇合適型號(hào)規(guī)格的產(chǎn)品�����。?
·從包裝取出球囊導(dǎo)管及通過止血閥時(shí)必須極度謹(jǐn)慎���,以保 證球囊系統(tǒng)完好無損或始終保持無菌狀態(tài)。
·請(qǐng)勿過早擴(kuò)張球囊��。不得超出建議的球囊最大推薦充盈壓 力�。
·如果您在導(dǎo)管插入期間明顯感覺到任何阻力,不得再用力 推動(dòng)導(dǎo)管��。此阻力能損害球囊導(dǎo)管�����。如果通過導(dǎo)引導(dǎo)管向 前推動(dòng)球囊導(dǎo)管時(shí)還存在阻力�,請(qǐng)撤回整套傳輸系統(tǒng)。?
·如需要����,同一球囊可以進(jìn)行二次擴(kuò)張�����。為避免藥物過量�, 不要使用第二個(gè)球囊對(duì)同一病變進(jìn)行重復(fù)擴(kuò)張����。?
·如果沒有按照上述步驟操作和/或過度用力推送或回撤導(dǎo) 管,則可能導(dǎo)致導(dǎo)管配件的脫落或損壞����。?
·如為了處理下一個(gè)血管或病變而需要保留導(dǎo)絲目前的位 置時(shí),則將導(dǎo)絲留在原位上���,只移動(dòng)導(dǎo)管的所有其他所有 配件���。?
優(yōu)美莫司涂層冠狀動(dòng)脈球囊擴(kuò)張導(dǎo)管禁用于以下情形:?
2.不能進(jìn)行經(jīng)皮球囊血管成形術(shù)的患者?
4.對(duì)優(yōu)美莫司及其衍生物過敏者?
7.其他不利于球囊輸送或球囊擴(kuò)張的病變(如嚴(yán)重鈣化病 變、靶病變扭曲等)?
10.經(jīng)處理后��,冠狀動(dòng)脈靶血管仍然完全閉塞導(dǎo)致球囊無法 通過?
綜合評(píng)價(jià)意見?
本申報(bào)產(chǎn)品屬于創(chuàng)新醫(yī)療器械(創(chuàng)新編號(hào):CQTS2100097)��。依據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國務(wù)院令第 739 號(hào))���、《醫(yī)療器械注冊(cè)與備案管理辦法》(國家市場監(jiān)督管理總局令 2021 年第 47 號(hào))等相關(guān)醫(yī)療器械法規(guī)與配套規(guī)章�,經(jīng)對(duì)申請(qǐng)人提交的注冊(cè)申報(bào)資料進(jìn)行系統(tǒng)評(píng)價(jià),申報(bào)產(chǎn)品符合安全性、有效性的要 求����,符合現(xiàn)有認(rèn)知水平,建議準(zhǔn)予注冊(cè)���。
